题目内容
15.已知aA+、bB2+、cC-、dD2-均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )| A. | 原子半径:A>B>C>D | B. | 原子序数:b>a>c>d | ||
| C. | 金属性:B>A,非金属性:D>C | D. | 离子半径:D>C>A>B |
分析 aA+、bB2+、cC-、dD2-四种离子均具有相同的电子层结构,则有:a-1=b-2=c+1=d+2,故原子序数:b>a>c>d,且A与B同周期,C与D同周期,A、B在周期表中C、D的下一周期,由电荷可知,A、B为金属元素,C、D为非金属性元素.
同周期自左而右原子半径减小、同主族自上而下原子半径增大,同周期自左而右金属性减弱、非金属性增强,电子层结构相同的离子,核电荷数越大离子半径越小.
解答 解:aA+、bB2+、cC-、dD2-四种离子均具有相同的电子层结构,则有:a-1=b-2=c+1=d+2,故原子序数:b>a>c>d,且A与B同周期,C与D同周期,A、B在周期表中C、D的下一周期.
A.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:A>B>D>C,故A错误;
B.aA+、bB2+、cC-、dD2-四种离子均具有相同的电子层结构,则有:a-1=b-2=c+1=d+2,故原子序数:b>a>c>d,故B正确;
C.由电荷可知,A、B为金属元素,C、D为非金属性元素,同周期自左而右金属性减弱、非金属性增强,故金属性:A>B,非金属性:C>D,故C错误;
D.核电荷数:D<C<A<B,电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:D>C>A>B,故D正确,
故选BD.
点评 本题考查位置结构性质的相互关系及应用,明确核外电子排布确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,题目难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
3.元素在元素周期表中的分区说法正确的是( )
| A. | S区的元素一定是主族元素 | B. | d区元素一定是副族元素 | ||
| C. | p区的元素一定是主族元素 | D. | ds区元素一定是副族元素 |
10.把碘从碘和砂子的混合物中分离出来,可用的方法是( )
| A. | 过滤 | B. | 结晶 | C. | 蒸馏 | D. | 升华 |
20.下列说法正确的是( )
| A. | 非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价 | |
| B. | 只有非金属能形成含氧酸或含氧酸盐 | |
| C. | 除稀有气体外的非金属元素都能生成不同价态的含氧酸 | |
| D. | 非金属的最高价含氧酸不一定具有强氧化性 |
7.(1)CH3+、-CH3(甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是CD.
A.它们均由甲烷去掉一个氢原子所得 B.它们碳原子均采取sp2杂化
C.CH3-与NH3、H3O+几何构型均为三角锥形 D.CH3+中的碳原子采取sp2杂化,所有原子均共面
(2)N2与O22+互为等电子体,O22+的电子式可表示为 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.
(3)X、Y两种有机物的分子结构和部分物理性质如下表,二者物理性质有差异的主要原因是X物质形成分子内氢键,Y物质形成分子间氢键.
A.它们均由甲烷去掉一个氢原子所得 B.它们碳原子均采取sp2杂化
C.CH3-与NH3、H3O+几何构型均为三角锥形 D.CH3+中的碳原子采取sp2杂化,所有原子均共面
(2)N2与O22+互为等电子体,O22+的电子式可表示为
 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.(3)X、Y两种有机物的分子结构和部分物理性质如下表,二者物理性质有差异的主要原因是X物质形成分子内氢键,Y物质形成分子间氢键.
| 代号 | 结构简式 | 水中溶解度/g(25℃) | 熔点/℃ | 沸点/℃ |
| X | 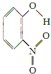 | 0.2 | 45 | 100 |
| Y | 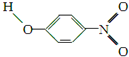 | 1.7 | 114 | 295 |
4.下列有关叙述正确的是( )
| A. | SO2的水溶液能导电,所以SO2是电解质 | |
| B. | BaSO4难溶于水,其水溶液的导电能力极弱,所以BaSO4是弱电解质 | |
| C. | 液溴不导电,所以液溴是非电解质 | |
| D. | HI熔融状态不能导电,但HI是强电解质 |
5.下列变化中必须加入还原剂才能进行的是( )
| A. | H2O→H2 | B. | CuO→Cu | C. | Fe3+→Fe2+ | D. | Zn→Zn2+ |