题目内容
5.下列变化中必须加入还原剂才能进行的是( )| A. | H2O→H2 | B. | CuO→Cu | C. | Fe3+→Fe2+ | D. | Zn→Zn2+ |
分析 变化中某元素的化合价降低,发生还原反应,则一般需要加入还原剂才能实现氧化还原反应.注意通过分解反应可以实现的,不一定需要加入还原剂.
解答 解:A.H元素化合价降低,但可通过电解生成,无需加入还原剂,故A错误;
B.Cu元素化合价降低,被还原,应加入还原剂才能实现,故B正确;
C.Fe元素化合价降低,被还原,应加入还原剂才能实现,故C正确;
D.Zn元素化合价升高,被氧化,应加入氧化剂,故D错误.
故选BC.
点评 本题考查氧化还原反应,明确元素的化合价降低时物质被还原、元素的化合价升高时被氧化是解答本题的关键,注意注意通过分解反应可以实现的,不一定需要加入还原剂或氧化剂,题目难度不大.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
15.已知aA+、bB2+、cC-、dD2-均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
| A. | 原子半径:A>B>C>D | B. | 原子序数:b>a>c>d | ||
| C. | 金属性:B>A,非金属性:D>C | D. | 离子半径:D>C>A>B |
16.4.48L一定条件下的氯化氢气体通入水中得到0.1L盐酸,此溶液中c(Cl-)=2mol/L,则“一定条件”可能是( )
| A. | 25℃ | B. | 1.01×103Pa | C. | 101kPa | D. | 0℃ |
10.从2mol/L的氯化铜溶液中取出含Cl-为0.5mol的溶液,所取溶液的体积是( )
| A. | 1 L | B. | 0.5 L | C. | 0.25 L | D. | 0.125L |
2. 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: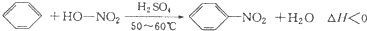
存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯,有关数据如表:
实验步骤如下:
取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混合液,将混合酸小心加入B中.把18mL(15.84g)苯加入A中.向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀,在50~60℃下发生反应,直至反应结束.
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤.分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯18g.回答下列问题:
(1)装置B的名称是分液漏斗,装置C的作用是冷凝回流.
(2)配制混合液时,能否将浓硝酸加入到浓硫酸中,说明理由:不能,容易发生迸溅.
(3)为了使反应在50℃~60℃下进行,常用的方法是水浴加热.
(4)在洗涤操作中,第二次水洗的作用是洗去残留的NaOH及生成的盐.
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用直形冷凝管的原因是以免直形冷凝管通水冷却时导致温差过大而发生炸裂.
(6)本实验所得到的硝基苯产率是72%.
 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: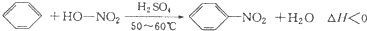
存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯,有关数据如表:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混合液,将混合酸小心加入B中.把18mL(15.84g)苯加入A中.向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀,在50~60℃下发生反应,直至反应结束.
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤.分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯18g.回答下列问题:
(1)装置B的名称是分液漏斗,装置C的作用是冷凝回流.
(2)配制混合液时,能否将浓硝酸加入到浓硫酸中,说明理由:不能,容易发生迸溅.
(3)为了使反应在50℃~60℃下进行,常用的方法是水浴加热.
(4)在洗涤操作中,第二次水洗的作用是洗去残留的NaOH及生成的盐.
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用直形冷凝管的原因是以免直形冷凝管通水冷却时导致温差过大而发生炸裂.
(6)本实验所得到的硝基苯产率是72%.
20.下列四种X溶液均能与一定量的盐酸反应,则其中反应最快的是( )
| A. | 10℃时,20mL3mol/L的X溶液 | B. | 20℃时,30mL2mol/L的X溶液 | ||
| C. | 20℃时,20mL4mol/L的X溶液 | D. | 10℃时,10mL2mol/L的X溶液 |

 保持营养平衡、科学使用食品添加剂并合理使用药物,有助于健康和提高人体自身免疫力.
保持营养平衡、科学使用食品添加剂并合理使用药物,有助于健康和提高人体自身免疫力. )必须密闭干燥存储以防止发生水解,其水解的化学方程式为
)必须密闭干燥存储以防止发生水解,其水解的化学方程式为 .
.