题目内容
20.下列说法正确的是( )| A. | 非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价 | |
| B. | 只有非金属能形成含氧酸或含氧酸盐 | |
| C. | 除稀有气体外的非金属元素都能生成不同价态的含氧酸 | |
| D. | 非金属的最高价含氧酸不一定具有强氧化性 |
分析 A.非金属元素R的含氧酸根中,氧元素对共用电子对吸引更强,R应为正价;
B.金属性较弱的金属也可形成含氧酸或含氧酸盐;
C.O、F不存在含氧酸;
D.碳酸、硅酸等不具有强氧化性.
解答 解:A.非金属元素R的含氧酸根中,氧元素对共用电子对吸引更强,R应为正价,故A正确;
B.金属性较弱的金属也可形成含氧酸或含氧酸盐,如铝、锰等,故B错误;
C.O、F不存在含氧酸,故C错误;
D.碳酸、硅酸等不具有强氧化性,故D正确.
故选AD.
点评 本题考查元素周期律知识,为高考常见题型和高频考点,侧重于学生的分析能力和基本概念知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
10.下列说法正确的是( )
| A. | 焓变是指1mol物质参加反应时的能量变化 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应体系中,反应物的总焓总是高于生成物的总焓 | |
| D. | 物质发生化学变化都伴随着能量变化 |
11.下列有关化学用语正确的是( )
| A. | CO2的电子式  | |
| B. | Cl-的结构示意图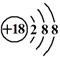 | |
| C. | 8个中子的碳原子的核素符号:${\;}_{6}^{14}$C | |
| D. | HF的电子式: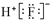 |
15.已知aA+、bB2+、cC-、dD2-均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
| A. | 原子半径:A>B>C>D | B. | 原子序数:b>a>c>d | ||
| C. | 金属性:B>A,非金属性:D>C | D. | 离子半径:D>C>A>B |
5.以下有关原子结构及元素周期律的叙述正确的是( )
| A. | 第ⅠA族元素铯的两种位素${\;}_{\;}^{137}$Cs比${\;}_{\;}^{133}$Cs多4个质子 | |
| B. | 第ⅦA族元素从上到下,其氢化物的还原性逐渐减弱 | |
| C. | 同主族元素原子半径越大,单质的熔点越高 | |
| D. | 同周期元素(除0族元素外)从左到右,简单阴离子半径逐渐减小 |
12.在平衡体系Ca(OH)2(s)?Ca2+(aq)+2OH-(aq)中,能使c(Ca2+)减小,而使c(OH-)增大的是( )
| A. | 加入少量MgCl2固体 | B. | 继续加水 | ||
| C. | 加入少量Na2CO3固体 | D. | 升高温度 |
9.下列热化学方程式或离子方程式中,正确的是( )
| A. | 甲烷的燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 硫酸与氢氧化钡发生中和反应的热化学方程式为:H+(aq)+SO42-(aq)+Ba2+(aq)+OH-(aq)=BaSO4(s)+H2O(l)△H=-57.3kJ•mol-1 | |
| D. | 氯化镁溶液与氨水反应:Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+ |
10.从2mol/L的氯化铜溶液中取出含Cl-为0.5mol的溶液,所取溶液的体积是( )
| A. | 1 L | B. | 0.5 L | C. | 0.25 L | D. | 0.125L |