题目内容
19. 硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应:ⅠSO2+2H2O+I2=H2SO4+2HI
Ⅱ2HI?H2+I2(g)
Ⅲ2H2SO4=2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是C.
A.反应Ⅲ易在常温下进行
B.反应Ⅰ中SO2氧化性比HI强
C.循环过程需补充H2O
D.循环过程产生1molO2的同时产生1molH2
(2)在一定条件下,体积不变的密闭容器中,能说明反应Ⅱ达到化学平衡状态的是A.
A.混合气体的颜色不再变化
B.混合气体的密度不再改变
C.反应混合物中各组分物质的浓度相等
D.H2、HI、I2三种物质的反应速率之比为1:2:1
E.容器中气体压强不变
(3)一定温度下,向1L密闭容器中加入1molHI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示.
①0~2min内的平均反应速率v(HI)=0.1mol/(L.min).
②下列关于化学反应速率的说法正确的是C.
A.对任何化学反应来说,反应速率越大,反应现象就越明显
B.化学反应速率常用单位时间内任何一种反应物物质的量的减小或生成物物质的量的增加来表示
C.在一定条件下,可逆反应达到化学平衡状态时,正、逆反应的速率不再改变
D.增大反应物的浓度、降低反应的温度都能增大反应速率
③A点的逆反应速率v逆(H2)小于B点的正反应速率v正(H2)(填“大于”“小于”或“等于”).
分析 (1)A.硫酸常温下,不易分解;
B.反应中二氧化硫表现还原性,氧化性比HI强;
C.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O;
D.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2;
(2)可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度不再变化;该反应的特点为:一是可逆反应;二是反应前后气体体积不相等;根据气体压强之比等于气体物质的量之比推断,该反应在整个反应过程中总压强是不变化的;
(3)①由图可知,2min内H2物质的量的变化量,然后计算化学反应速率,再利用化学反应速率之比等于化学计量数之比来解答;
②A、反应速率与反应现象没有直接关系;
B、化学反应速率是用单位时间内浓度的变化量来表示的;
C、在一定条件下,可逆反应达到化学平衡状态时,正、逆反应的速率相等;
D、增大浓度能使反应速率加快,降低反应的温度则减小反应速率;
③B点反应向正反应方向移动,所以正反应速率v正(H2)在减小,又A点为平衡点,逆反应速率v逆(H2)=v正(H2),据此分析.
解答 解:(1)A.硫酸常温下温度,不易分解,故A错误;
B.反应中二氧化硫表现还原性,还原性比HI强,碘单质氧化性大于二氧化硫,故B错误;
C.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O,循环中水的量减少,故应补充水,故C正确;
D.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2,即循环过程中产生l mol O2的同时产生2mol H2,故D错误;
故答案为:C;
(2)反应Ⅱ为2HI?H2+I2
A.混合气体的颜色不再变化,说明物质浓度不变,反应达到平衡状态,故A正确;
B.反应前后气体质量和体积不变,混合气体的密度始终不改变,不能说明反应达到平衡状态,故B错误;
C.物质浓度和起始量、变化量有关,反应混合物中各组分物质的浓度相等不能说明反应达到平衡状态,故C错误;
D.H2、HI、I2三种物质的反应速率之比为1:2:1,只能说明该反应的正反应速率之比,但不能说明正逆反应速率相同,故D错误;
E.反应前后气体体积不变,压强始终不变,容器中气体压强不变不能说明反应达到平衡状态,故E错误.
故答案为:A;
(3)①由图可知2min内氢气的物质的量增加了0.1mol,则氢气的浓度为$\frac{0.1mol}{1L}$=0.1mol/L,用氢气表示的化学反应速率为$\frac{0.1mol/L}{2min}$=0.05mol/(L.min),
由反应中的化学计量数可知v(HI)=0.05mol/(L.min)×2=0.1mol/(L.min),
故答案为:0.1mol/(L.min);
②A、反应速率快的现象不一定明显,如NaOH与HCl的反应,反应速率慢的现象可能明显,如铁生锈,故A错误;
B、化学反应速率常用单位时间内任何一种反应物物质的量浓度的减小或生成物物质的量浓度的增加来表示,故B错误;
C、在一定条件下,可逆反应达到化学平衡状态时,正、逆反应的速率相等,所以不再改变,故C正确;
D、增大浓度使活化分子数目增多则能使反应速率加快,降低温度使活化分子百分数减小,则能使反应速率减慢,故D错误;
故答案为:C;
③B点反应向正反应方向移动,所以正反应速率v正(H2)在减小,所以A点的正反应速率v正(H2)小于B点的正反应速率v正(H2),又A点为平衡点,逆反应速率v逆(H2)=v正(H2),即A点的逆反应速率v逆(H2)小于B点的正反应速率v正(H2),故答案为:小于.
点评 本题主要考查了反应方程式的分析及计算,反应平衡图象,化学平衡标志、化学平衡和反应速率影响因素的分析应用,难度中等.对于图象,要看清图象的含义、拐点、平衡点,结合平衡移动规律进行判断.

 能力评价系列答案
能力评价系列答案| A. | 将氯气溶于水:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 向碳酸氢钙溶液中加入过量的氢氧化钠:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| C. | 用FeCl3溶液腐蚀铜线路板:Cu+Fe3+=Cu2++Fe2+ | |
| D. | 次氯酸钠溶液中通入足量CO2气体:ClO-+CO2+H2O=HClO+HCO3- |
①NaOH溶液 ②银氨溶液 ③新制Cu(OH)2悬浊液 ④碘水 ⑤BaCl2溶液.
| A. | ④ | B. | ③⑤ | C. | ②④ | D. | ①③④ |
 已知气体的摩尔质量越小,扩散速度越快.如图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环.下列关于甲、乙的判断正确的是( )
已知气体的摩尔质量越小,扩散速度越快.如图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环.下列关于甲、乙的判断正确的是( )| A. | 甲是浓氨水,乙是浓硫酸 | B. | 甲是浓盐酸,乙是浓氨水 | ||
| C. | 甲是浓氨水,乙是浓盐酸 | D. | 甲是浓硝酸,乙是浓氨水 |
| A. | Be的氧化物的水化物可能具有两性 | |
| B. | At2为有色固体,HAt不稳定,AgAt感光性很强,既不溶于水也不溶于稀酸 | |
| C. | HClO的酸性一定比H2SO4强 | |
| D. | H2Se是无色、有毒、不如H2S稳定的气体 |
| A. | 加碘食盐是在食盐中加入了碘的化合物 | |
| B. | 钙营养盐是在食盐中加入了氯化钙或碳酸钙等含钙的化合物 | |
| C. | 低钠盐中的钠离子比氯离子少,所以低钠盐是一种带负电的物质 | |
| D. | 各类营养盐的主要成分都是氯化钠 |
| A. | 在标准状况下,NA个水分子所占的体积约为22.4L | |
| B. | 5.6g铁与氯气完全反应,失去电子的数目为0.2NA | |
| C. | 1L 0.3mol•L-1Na2SO4溶液中,含有Na+和SO42-总数为0.6NA | |
| D. | 常温常压下,32g O2所含氧原子数是2NA |
| A. | 石油 | B. | 煤油 | C. | 甘油 | D. | 牛油 |
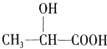 为原料制成的高分子材料具有生物兼容性.而且在哺乳动物内或自然环境中都可以最终降解成为二氧化碳和水,乳酸还有其他用途.
为原料制成的高分子材料具有生物兼容性.而且在哺乳动物内或自然环境中都可以最终降解成为二氧化碳和水,乳酸还有其他用途. +Fe→
+Fe→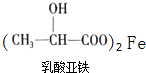 +H2↑
+H2↑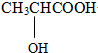 +CH3CH2OH
+CH3CH2OH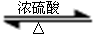
 +H2O;取代反应或酯化反应.
+H2O;取代反应或酯化反应.