题目内容
14.结合元素周期律的知识分析下列说法,其中错误的是( )| A. | Be的氧化物的水化物可能具有两性 | |
| B. | At2为有色固体,HAt不稳定,AgAt感光性很强,既不溶于水也不溶于稀酸 | |
| C. | HClO的酸性一定比H2SO4强 | |
| D. | H2Se是无色、有毒、不如H2S稳定的气体 |
分析 A.元素周期表中的对角线规则:处于对角线的元素具有相似性;
B.同主族元素性质具有相似性和递变性;
C.非金属性越强,最高价氧化物的水化物酸性越强;
D.非金属性越强,气态氢化物越稳定.
解答 解:A.元素周期表中Be和Al处于对角线位置上,处于对角线的元素具有相似性,则Be(OH)2有两性,故A正确;
B.卤族元素性质具有相似性,由单质的性质、氢化物的性质、银盐的性质可推知砹(At)为有色固体、HAt不稳定、;AgAt感光性很强,且不溶于水也不溶于稀酸,故B正确;
C.非金属性Cl>S,HClO4的酸性一定比H2SO4强,均大于HClO,HClO为弱酸,故C错误;
D、同主族元素的原子,从上到下氢化物的稳定性逐渐减弱,所以硒化氢(H2Se)不如H2S稳定,均为无色、有毒气体,故D正确.
故选C.
点评 本题考查元素周期律和元素周期律,为高频考点,把握同主族元素性质具有相似性也具有一定的递变规律为解答的关键,注意把握元素周期律的有关知识,题目难度不大.

练习册系列答案
相关题目
2.含氧酸的元数等于羟基氢的个数,氢氧化钠只能中和连在氧上的羟基氢,磷元素有多种含氧酸,如次磷酸(H3PO2)、亚磷酸(H3P03)、磷酸等,它们分别为一元、二 元、三元弱酸或中强酸.
(1)其中次磷酸钠常用来给腈纶织物进行化学镀,某种碱性化学镀铜试剂的配方有次磷酸钠和硫酸铜,产物中有亚磷酸钠的正盐,请写出相关离子方程式:H2PO2-+Cu2++3OH-=Cu↓+HPO32-+2H2O.
(2)亚磷酸可以由三氯化磷水解得到,也可以由电解亚磷酸钠来制备,如图1是用一个六室电渗析槽制备亚磷酸.其中阳极室和产品室之间的阳离子膜主要目的是防止:2H3PO3+O2=2H3PO4(只要求写出化学方程式),这种方法的产品除了有亚磷酸,还有:氧气、氢气、氢氧化钠,如果去掉右边两个阳离子膜(没有了右边的缓冲室),带来的不利后果是(填序号):B.
A、氢氧化钠与原料Na2HP03会发生反应 B、导致产品氢氧化钠中混有杂质,难以分离.
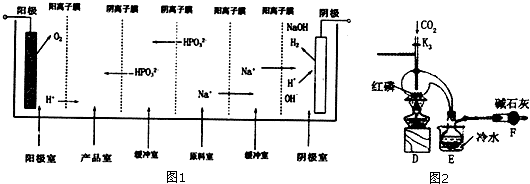
(3)三氯化磷(PC13)是一种重要的有机合成催化剂,实验室常用红磷与干燥的Cl2制取PC13,装置如图2所示.PCl3遇02会生成POCl3 (三氯氧磷),POCl3溶于PC13,PC13遇水会强烈水解生成亚磷酸和HCl,PCl3、POCl3的熔沸点见如表.
请回答:
①E烧杯内冷水的作用是冷凝PCl3蒸汽,便于PCl3收集.
②干燥管F的作用是收尾气中氯气,以免污染空气,防止空气中的水蒸气进入烧瓶使PCl3水解.
③检査装置气密性后,向D装置的曲颈瓶中加人红磷,打开K3通人干燥的CO2,一段时间后关闭K3,加热曲颈瓶至上部有黄色升华物出现时通人氯气,反应立即进行,其中通人干燥CO2的目的是排尽曲颈瓶中的空气,防止PC13与O3等发生副反应.
(4)实验制得的粗产品中常含有POC13、PC15等,加入红磷加热除去PC15后,再通过蒸馏(填实验名称)即可得到较纯净的PC13.
(1)其中次磷酸钠常用来给腈纶织物进行化学镀,某种碱性化学镀铜试剂的配方有次磷酸钠和硫酸铜,产物中有亚磷酸钠的正盐,请写出相关离子方程式:H2PO2-+Cu2++3OH-=Cu↓+HPO32-+2H2O.
(2)亚磷酸可以由三氯化磷水解得到,也可以由电解亚磷酸钠来制备,如图1是用一个六室电渗析槽制备亚磷酸.其中阳极室和产品室之间的阳离子膜主要目的是防止:2H3PO3+O2=2H3PO4(只要求写出化学方程式),这种方法的产品除了有亚磷酸,还有:氧气、氢气、氢氧化钠,如果去掉右边两个阳离子膜(没有了右边的缓冲室),带来的不利后果是(填序号):B.
A、氢氧化钠与原料Na2HP03会发生反应 B、导致产品氢氧化钠中混有杂质,难以分离.

(3)三氯化磷(PC13)是一种重要的有机合成催化剂,实验室常用红磷与干燥的Cl2制取PC13,装置如图2所示.PCl3遇02会生成POCl3 (三氯氧磷),POCl3溶于PC13,PC13遇水会强烈水解生成亚磷酸和HCl,PCl3、POCl3的熔沸点见如表.
| 物质 | 熔点/℃ | 沸点/℃ |
| PC13 | -112 | 75.5 |
| POCI3 | 2 | 105.3 |
①E烧杯内冷水的作用是冷凝PCl3蒸汽,便于PCl3收集.
②干燥管F的作用是收尾气中氯气,以免污染空气,防止空气中的水蒸气进入烧瓶使PCl3水解.
③检査装置气密性后,向D装置的曲颈瓶中加人红磷,打开K3通人干燥的CO2,一段时间后关闭K3,加热曲颈瓶至上部有黄色升华物出现时通人氯气,反应立即进行,其中通人干燥CO2的目的是排尽曲颈瓶中的空气,防止PC13与O3等发生副反应.
(4)实验制得的粗产品中常含有POC13、PC15等,加入红磷加热除去PC15后,再通过蒸馏(填实验名称)即可得到较纯净的PC13.
6.化学与生活息息相关,下列说法正确的是( )
| A. | 铝合金表面有致密氧化膜遇强碱不会被腐蚀 | |
| B. | 海轮外壳上装锌块可减缓腐蚀 | |
| C. | 高纯度的SiO2由于可以导电因此可用作光导纤维 | |
| D. | SO2、CO2和NO2都是可形成酸雨的气体 |
3.对下列事实的解释错误的是( )
| A. | 浓硝酸在光照下颜色变黄,说明浓硝酸的不稳定性 | |
| B. | 常温下,铝制品可盛放浓硝酸,说明浓硝酸与铝不反应 | |
| C. | 蓝色石蕊试纸上滴入浓硝酸,试纸先变红再变白,说明浓硝酸有酸性和氧化性 | |
| D. | 二氧化氮受热后颜色变深,说明二氧化氮与四氧化氮共存 |

 硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应: 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示,下列有关叙述正确的是( )