题目内容
11.若NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 在标准状况下,NA个水分子所占的体积约为22.4L | |
| B. | 5.6g铁与氯气完全反应,失去电子的数目为0.2NA | |
| C. | 1L 0.3mol•L-1Na2SO4溶液中,含有Na+和SO42-总数为0.6NA | |
| D. | 常温常压下,32g O2所含氧原子数是2NA |
分析 A、标况下,水为液态;
B、求出铁的物质的量,然后根据铁与氯气反应后变为+3价来分析;
C、求出Na2SO4的物质的量n=CV,然后根据1molNa2SO4中含2mol钠离子和1mol硫酸根来分析;
D、求出氧气的物质的量,然后根据1mol氧气含2mol氧原子来计算.
解答 解:A、标况下,水为液态,故NA个水分子的体积小于22.4L,故A错误;
B、5.6g铁的物质的量为0.1mol,而铁与足量氯气能完全反应,且反应后铁变为+3价,故0.1mol铁失0.3mol电子即0.3NA个,故B错误;
C、Na2SO4的物质的量n=CV=0.3mol/L×1L=0.3mol,而1molNa2SO4中含2mol钠离子和1mol硫酸根,故0.3mol硫酸钠溶液中含有的Na+和SO42-总物质的量为0.9mol,个数为0.9NA个,故C错误;
D、32g氧气的物质的量为1mol,而1mol氧气含2mol氧原子,故含有的氧原子的个数为2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
5.下列各组离子一定能大量共存的是( )
| A. | 在透明溶液中:NH4+、Fe2+、SO42-、Cl- | |
| B. | 在强酸性溶液中:K+、Fe2+、Cl-、NO3- | |
| C. | 在强碱性溶液中:Na+、K+、Cl-、NH4+ | |
| D. | 与铝作用产生H2的溶液:Mg2+、K+、Cl-、SO42- |
2.含氧酸的元数等于羟基氢的个数,氢氧化钠只能中和连在氧上的羟基氢,磷元素有多种含氧酸,如次磷酸(H3PO2)、亚磷酸(H3P03)、磷酸等,它们分别为一元、二 元、三元弱酸或中强酸.
(1)其中次磷酸钠常用来给腈纶织物进行化学镀,某种碱性化学镀铜试剂的配方有次磷酸钠和硫酸铜,产物中有亚磷酸钠的正盐,请写出相关离子方程式:H2PO2-+Cu2++3OH-=Cu↓+HPO32-+2H2O.
(2)亚磷酸可以由三氯化磷水解得到,也可以由电解亚磷酸钠来制备,如图1是用一个六室电渗析槽制备亚磷酸.其中阳极室和产品室之间的阳离子膜主要目的是防止:2H3PO3+O2=2H3PO4(只要求写出化学方程式),这种方法的产品除了有亚磷酸,还有:氧气、氢气、氢氧化钠,如果去掉右边两个阳离子膜(没有了右边的缓冲室),带来的不利后果是(填序号):B.
A、氢氧化钠与原料Na2HP03会发生反应 B、导致产品氢氧化钠中混有杂质,难以分离.
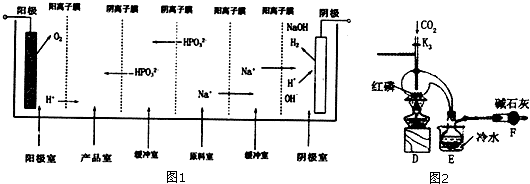
(3)三氯化磷(PC13)是一种重要的有机合成催化剂,实验室常用红磷与干燥的Cl2制取PC13,装置如图2所示.PCl3遇02会生成POCl3 (三氯氧磷),POCl3溶于PC13,PC13遇水会强烈水解生成亚磷酸和HCl,PCl3、POCl3的熔沸点见如表.
请回答:
①E烧杯内冷水的作用是冷凝PCl3蒸汽,便于PCl3收集.
②干燥管F的作用是收尾气中氯气,以免污染空气,防止空气中的水蒸气进入烧瓶使PCl3水解.
③检査装置气密性后,向D装置的曲颈瓶中加人红磷,打开K3通人干燥的CO2,一段时间后关闭K3,加热曲颈瓶至上部有黄色升华物出现时通人氯气,反应立即进行,其中通人干燥CO2的目的是排尽曲颈瓶中的空气,防止PC13与O3等发生副反应.
(4)实验制得的粗产品中常含有POC13、PC15等,加入红磷加热除去PC15后,再通过蒸馏(填实验名称)即可得到较纯净的PC13.
(1)其中次磷酸钠常用来给腈纶织物进行化学镀,某种碱性化学镀铜试剂的配方有次磷酸钠和硫酸铜,产物中有亚磷酸钠的正盐,请写出相关离子方程式:H2PO2-+Cu2++3OH-=Cu↓+HPO32-+2H2O.
(2)亚磷酸可以由三氯化磷水解得到,也可以由电解亚磷酸钠来制备,如图1是用一个六室电渗析槽制备亚磷酸.其中阳极室和产品室之间的阳离子膜主要目的是防止:2H3PO3+O2=2H3PO4(只要求写出化学方程式),这种方法的产品除了有亚磷酸,还有:氧气、氢气、氢氧化钠,如果去掉右边两个阳离子膜(没有了右边的缓冲室),带来的不利后果是(填序号):B.
A、氢氧化钠与原料Na2HP03会发生反应 B、导致产品氢氧化钠中混有杂质,难以分离.

(3)三氯化磷(PC13)是一种重要的有机合成催化剂,实验室常用红磷与干燥的Cl2制取PC13,装置如图2所示.PCl3遇02会生成POCl3 (三氯氧磷),POCl3溶于PC13,PC13遇水会强烈水解生成亚磷酸和HCl,PCl3、POCl3的熔沸点见如表.
| 物质 | 熔点/℃ | 沸点/℃ |
| PC13 | -112 | 75.5 |
| POCI3 | 2 | 105.3 |
①E烧杯内冷水的作用是冷凝PCl3蒸汽,便于PCl3收集.
②干燥管F的作用是收尾气中氯气,以免污染空气,防止空气中的水蒸气进入烧瓶使PCl3水解.
③检査装置气密性后,向D装置的曲颈瓶中加人红磷,打开K3通人干燥的CO2,一段时间后关闭K3,加热曲颈瓶至上部有黄色升华物出现时通人氯气,反应立即进行,其中通人干燥CO2的目的是排尽曲颈瓶中的空气,防止PC13与O3等发生副反应.
(4)实验制得的粗产品中常含有POC13、PC15等,加入红磷加热除去PC15后,再通过蒸馏(填实验名称)即可得到较纯净的PC13.
6.化学与生活息息相关,下列说法正确的是( )
| A. | 铝合金表面有致密氧化膜遇强碱不会被腐蚀 | |
| B. | 海轮外壳上装锌块可减缓腐蚀 | |
| C. | 高纯度的SiO2由于可以导电因此可用作光导纤维 | |
| D. | SO2、CO2和NO2都是可形成酸雨的气体 |
16.下列实验能达到预期目的是( )
| A. | 向米汤中加入含碘的食盐,观察是否有颜色的变化--检验含碘食盐中是否含碘酸钾 | |
| B. | 向淀粉溶液中加入稀硫酸,加热,再用NaOH中和,并做银镜反应实验--检验淀粉是否水解 | |
| C. | 向甲酸和甲醛的混合物中加入氢氧化钠溶液中和甲酸后,加入新制的氢氧化铜,加热--检验混合物中是否含有甲醛 | |
| D. | 向混有少量乙酸和乙醇杂质的乙酸乙酯中,加入氢氧化钠溶液,然后分液--提纯乙酸乙酯 |
3.对下列事实的解释错误的是( )
| A. | 浓硝酸在光照下颜色变黄,说明浓硝酸的不稳定性 | |
| B. | 常温下,铝制品可盛放浓硝酸,说明浓硝酸与铝不反应 | |
| C. | 蓝色石蕊试纸上滴入浓硝酸,试纸先变红再变白,说明浓硝酸有酸性和氧化性 | |
| D. | 二氧化氮受热后颜色变深,说明二氧化氮与四氧化氮共存 |
20.“类推”的思维方式在化学学习与研究中经常采用,但有时会产生错误结论.下列类推结论中,正确的是
( )
( )
| A. | 由氢氟酸刻蚀玻璃可推知盐酸也能用来刻蚀玻璃 | |
| B. | 由钠与冷水剧烈反应,可推知钾也能与冷水剧烈反应 | |
| C. | 由Na2O中阴阳离子个数比为1:2,可推出Na2O2中阴阳离子个数比为 1:1 | |
| D. | 由“2Fe+3Br2=2FeBr3”反应可推出“2Fe+3I2=2FeI3”反应也能发生 |
1.按等物质的量混合的下列气体,碳元素的质量分数最大的是( )
| A. | 甲烷和乙烷 | B. | 乙炔和丙烯 | C. | 乙烷和乙烯 | D. | 丁炔和乙烯 |
 硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应: