题目内容
8.今年来,乳酸成为研究热点之一,乳酸可以用化学方法合成,也可以由淀粉通过发酵法制备.利用乳酸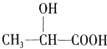 为原料制成的高分子材料具有生物兼容性.而且在哺乳动物内或自然环境中都可以最终降解成为二氧化碳和水,乳酸还有其他用途.
为原料制成的高分子材料具有生物兼容性.而且在哺乳动物内或自然环境中都可以最终降解成为二氧化碳和水,乳酸还有其他用途.(1)请写出乳酸分子中官能团的名称羧基、羟基;
(2)乳酸能与纯铁粉反应制备一种补铁药物
 +Fe→
+Fe→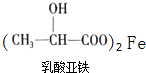 +H2↑
+H2↑该反应中的还原剂是Fe;
(3)乳酸发生下列变化
 $\stackrel{a}{→}$CH3CH(OH)COONa$\stackrel{b}{→}$CH3CH(ONa)COONa,所用的试剂是aNaOH、Na2CO3或NaHCO3,bNa(写化学式).
$\stackrel{a}{→}$CH3CH(OH)COONa$\stackrel{b}{→}$CH3CH(ONa)COONa,所用的试剂是aNaOH、Na2CO3或NaHCO3,bNa(写化学式).(4)请写出乳酸与乙醇反应的化学方程式,并注明反应类型:
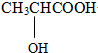 +CH3CH2OH
+CH3CH2OH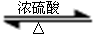
 +H2O;取代反应或酯化反应.
+H2O;取代反应或酯化反应.
分析 (1)乳酸的官能团是羟基和羧基;
(2)该反应中Fe元素化合价由0价变为+2价,失电子化合价升高的反应物是还原剂;
(3)羧基和NaOH、Na2CO3、NaHCO3发生反应生成-COONa,醇羟基和Na反应生成-ONa;
(4)乳酸和乙醇发生酯化反应生成乳酸乙酯和水,该反应是取代反应或酯化反应.
解答 解:(1)根据乳酸结构简式知,乳酸的官能团是羟基和羧基,故答案为:羧基;羟基;
(2)该反应中Fe元素化合价由0价变为+2价,失电子化合价升高的反应物是还原剂,所以Fe作还原剂,故答案为:Fe;
(3)羧基和NaOH、Na2CO3、NaHCO3发生反应生成-COONa,醇羟基和Na反应生成-ONa,加入a时乳酸中羧基变为-COONa,所以a可能是NaOH、Na2CO3或NaHCO3;加入b后,CH3CH(OH)COONa生成CH3CH(ONa)COONa,醇羟基只能和Na反应,所以b是Na,
故答案为:NaOH、Na2CO3或NaHCO3;Na;
(4)乳酸和乙醇发生酯化反应生成乳酸乙酯和水,该反应是取代反应或酯化反应,反应方程式为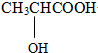 +CH3CH2OH
+CH3CH2OH
 +H2O,
+H2O,
故答案为: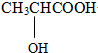 +CH3CH2OH
+CH3CH2OH
 +H2O;取代反应或酯化反应.
+H2O;取代反应或酯化反应.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,难点是(3)题试剂的选取,注意羧基和醇羟基的区别,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列物质的水溶液中,除水分子外,还存在其他分子的是( )
| A. | HCl | B. | CH3COOH | C. | KNO3 | D. | NaOH |
16.下列实验能达到预期目的是( )
| A. | 向米汤中加入含碘的食盐,观察是否有颜色的变化--检验含碘食盐中是否含碘酸钾 | |
| B. | 向淀粉溶液中加入稀硫酸,加热,再用NaOH中和,并做银镜反应实验--检验淀粉是否水解 | |
| C. | 向甲酸和甲醛的混合物中加入氢氧化钠溶液中和甲酸后,加入新制的氢氧化铜,加热--检验混合物中是否含有甲醛 | |
| D. | 向混有少量乙酸和乙醇杂质的乙酸乙酯中,加入氢氧化钠溶液,然后分液--提纯乙酸乙酯 |
3.对下列事实的解释错误的是( )
| A. | 浓硝酸在光照下颜色变黄,说明浓硝酸的不稳定性 | |
| B. | 常温下,铝制品可盛放浓硝酸,说明浓硝酸与铝不反应 | |
| C. | 蓝色石蕊试纸上滴入浓硝酸,试纸先变红再变白,说明浓硝酸有酸性和氧化性 | |
| D. | 二氧化氮受热后颜色变深,说明二氧化氮与四氧化氮共存 |
13.下列化合物既能因加成反应使溴水褪色,还能使KMnO4酸性溶液褪色的是( )
| A. | 乙烷 | B. | 乙醇 | C. | 丙烯(CH3CH=CH2) | D. | 苯 |
20.“类推”的思维方式在化学学习与研究中经常采用,但有时会产生错误结论.下列类推结论中,正确的是
( )
( )
| A. | 由氢氟酸刻蚀玻璃可推知盐酸也能用来刻蚀玻璃 | |
| B. | 由钠与冷水剧烈反应,可推知钾也能与冷水剧烈反应 | |
| C. | 由Na2O中阴阳离子个数比为1:2,可推出Na2O2中阴阳离子个数比为 1:1 | |
| D. | 由“2Fe+3Br2=2FeBr3”反应可推出“2Fe+3I2=2FeI3”反应也能发生 |
17.下列有关叙述中不正确的是( )
| A. | 第 VIIA族元素是同周期中非金属性最强的元素 | |
| B. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| C. | 元素周期表中从ⅠA到ⅡB之间12个纵列的元素都是金属元素 | |
| D. | 同周期元素中,ⅠA族元素的原子半径最大(稀有气体除外) |
18.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填元素符号,下同).
(2)在最高价氧化物的水化物中,酸性最强的化合物是HClO4,碱性最强的化合物是KOH;(填化学式 )
(3)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(4)表示①与⑦的化合物的电子式 ,该化合物含的共价键类型是极性共价键.
,该化合物含的共价键类型是极性共价键.
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物是HClO4,碱性最强的化合物是KOH;(填化学式 )
(3)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(4)表示①与⑦的化合物的电子式
 ,该化合物含的共价键类型是极性共价键.
,该化合物含的共价键类型是极性共价键.  硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应: