题目内容
【题目】碳、 氮、磷、砷和硼的相关化合物在化工、医药、农药、材料等领域有着广泛的应用。锂、钠、铝、铁等金属在日常生活、工业生产中也占有举足轻重的地位,请回答下列问题:
(1)基态As原子的电子排布式为______________________;
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中B—N—B之间的夹角是___________________(填角度)。
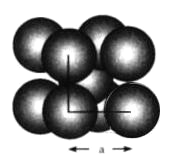
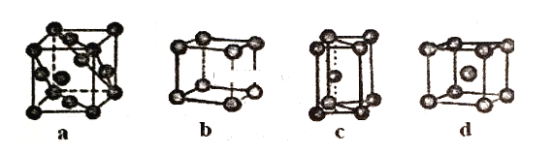
(3)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为___ (填字母)。
【答案】[Ar]3d104s24p3 109-28’ d
【解析】
(1)As是33号元素,在周期表中位于第4周期,第ⅤA族;
(2)立方氮化硼与金刚石的构型类似,金刚石中C原子的杂化方式为sp3杂化;
(3)金属钠晶体为体心立方堆积;
(1)As是33号元素,在周期表中位于第4周期,第ⅤA族,则其基态原子的电子排布式为:[Ar]3d104s24p3 ;
(2)立方氮化硼与金刚石的构型类似,金刚石中C原子的杂化方式为sp3杂化,所以晶胞中B-N-B之间的夹角是109°28′。
(3)金属钠晶体为体心立方堆积,故选d。

【题目】锌锰干电池是最早的实用电池。现用下列工艺回收正极材料中的金属(部分条件未给出)。

(1)碱性锌锰电池反应为:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH),电解质是KOH, MnO(OH)中Mn的化合价为:_____,正极反应式为:__________。
(2)黑粉的主要成份为 MnO2和石墨,写出反应①的化学方程式:________
(3)MnO2的转化率与温度的关系如下表:
温度/℃ | 20 | 40 | 60 | 80 | 100 |
转化率/℃ | 86.0 | 90.0 | 91.3 | 92.0 | 92.1 |
生产中常选反应温度为80℃,其理由是:___________。
(4)“沉锰”过程中生成碱式碳酸锰[MnCO36Mn(OH)25H2O],写出其离子反应方程式:_______。滤液③中可回收的物质为:________(填化学式)。
(5)用硫酸酸化的![]() 浆液可吸收工业废气中的
浆液可吸收工业废气中的![]() 生成
生成![]() ,已知浆液中
,已知浆液中![]() 含量为
含量为![]() ,工业废气中
,工业废气中![]() 含量为
含量为![]() ,
, ![]() 的吸收率可达90%,则处理1000
的吸收率可达90%,则处理1000![]() 工业尾气,可得到
工业尾气,可得到![]() 的质量为____kg(用含字母的代数式表示)。
的质量为____kg(用含字母的代数式表示)。