题目内容
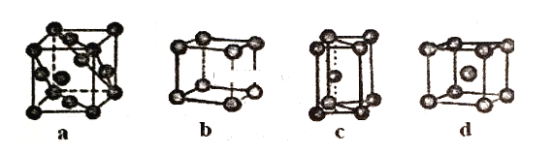
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为_____________。
(2)由A、B、W三种元素组成的18电子微粒的电子式为______________。
(3)若要比较D与E的金属性强弱,下列实验方法可行的是____________。
A. 将单质D置于E的盐溶液中,若D不能置换出单质E,说明D的金属性弱
B. 比较D和E的最高价氧化物对应水化物的碱性,前者比后者强,故前者金属性强
C. 将D、E的单质分别投入到同浓度的盐酸中,观察到D反应更剧烈,说明D的金属性强
【答案】第三周期 IIIA族 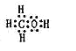 BC
BC
【解析】
A、B、W、D、E为短周期元素,且原子序数依次增大,A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期ⅢA族元素,故E为Al元素;A、B、W、D、E五元素质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素,据此分析解答。
根据上述分析,A为H元素,B为C元素,W为O元素,D为Na元素,E为Al元素;
(1)E为Al元素,原子序数为13,原子核外有3个电子层,最外层电子为3,位于周期表第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(2)由H、C、O三种元素组成的18电子微粒,该微粒中只能含有1个C原子、1个O原子,故含有H原子数目=18-6-8=4,故该微粒结构简式为CH3OH,电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
(3) D为Na元素,E为Al元素;A.将单质D置于E的盐溶液中,钠首先与水反应,不能置换盐溶液中的金属元素,不能说明D的金属性弱,故A错误;B.金属性越强,最高价氧化物对应水化物的碱性越强,比较D和E的最高价氧化物对应水化物的碱性,前者比后者强,故前者金属性强,故B正确;C.金属单质与盐酸反应越剧烈,对应元素的金属性越强,将D、E的单质分别投入到同浓度的盐酸中,观察到D反应更剧烈,说明D的金属性强,故C正确;
故答案为:BC。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知:

(1)探究BaCO3和BaSO4之间的转化,实验操作:
试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
实验Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | …… |
实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生,沉淀部分溶解 |
①实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,__________
②实验Ⅱ中加入稀盐酸后发生反应的离子方程式是_______。
③实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:______
(2)探究AgCl和AgI之间的转化,实验Ⅲ:
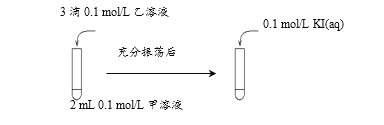
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。

注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
① 实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是______(填序号)。
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
② 实验Ⅳ的步骤ⅰ中,B中石墨上的电极反应式是 _______________
③ 结合信息,解释实验Ⅳ中b<a的原因:______。
④ 实验Ⅳ的现象能说明AgI转化为AgCl,理由是_______