题目内容
18.某温度下,取一定质量的硫酸铜溶液,用石墨作电极进行电解,当阳极产生0.025mol的气体时,CuSO4恰好被完全电解,得密度为1.2g/cm3的溶液100mL,求:(1)电解后所得溶液的pH=0.
(2)电解前所取CuSO4溶液的质量为124.0克.
(3)若要使电解后所得溶液恢复至电解前的原状态,需要加入的物质为(写化学式)CuO,质量为4.0克.
分析 用石墨电极电解CuSO4溶液,阳极反应为:4OH--4e-═2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu,总反应离子方程式为:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑,当阳极产生0.025mol的气体时,电子转移0.025mol×4=0.1mol,同时阴极析出铜6.4g,电解过程中依据出什么加什么原则,据此分析计算.
解答 解:(1)用石墨电极电解CuSO4溶液,阳极反应为:4OH--4e-═2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu;阳极产生0.025mol的气体为氧气,电子转移0.025mol×4=0.1mol,同时阴极析出铜3.2g,电解过程中,阳极反应为:4OH--4e-═2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu,总反应离子方程式为:
2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑,
2mol 4mol 1mol
n(Cu2+) n(H+) 0.025mol
n(H+)=$\frac{4×0.025}{1}$=0.1mol,c(H+)=$\frac{0.1mol}{0.1L}$=1mol/L,故pH=0,故答案为:0;
(2)析出氧气的质量为:0.025mol×32g/mol=0.8g,析出铜的质量为3.2g,故原溶液质量为:0.8g+3.2g+1.2g•cm-3×100mL=124.0g,
故答案为:124.0;
(3)电解过程中依据出什么加什么原则,电解过程中析出铜和氧气,所以要使电解后溶液恢复到电解前的状态加入氧化铜可以恢复溶液浓度,析出氧气的质量为0.025mol×32g/mol=0.8g,析出铜的质量为3.2g,故加入氧化铜的质量为0.8g+3.2g=4.0g,故答案为:CuO;4.0.
点评 本题考查了电解原理的应用,电极反应的书写方法,电子守恒的计算应用,中等难度,清楚电极反应是解题的关键.

| A. | 2CH3OH+3O2→2CO2+4H2O | B. | NaOH+HCl=NaCl+H2O | ||
| C. | Zn+2HCl=ZnCl2+H2↑ | D. | 4Al+3O2+6H2O=4Al(OH)3 |
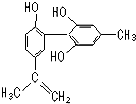 坚决反对运动员服用兴奋剂是保证运动会公平公正的重要举措之一.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
坚决反对运动员服用兴奋剂是保证运动会公平公正的重要举措之一.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 该分子中的所有碳原子不可能共平面 | |
| C. | 滴入KMnO4(H+)溶液,观察紫色变浅,是因为结构中存在碳碳双键 | |
| D. | 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为4 mol、7 mol |
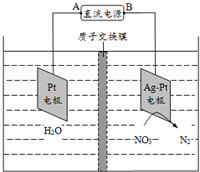
| A. | 电源的正极为b | |
| B. | 电解时H+从膜右侧迁移到膜左侧 | |
| C. | Ag-Pt电极反应为:2H2O-4e-=4H++O2↑ | |
| D. | 若转移的电子数为1.204×1024,生成N25.6 g |
| A. | 1:3 | B. | 3:1 | C. | 1:4 | D. | 5:13 |
| A. | 原子半径:r(A)>r(B)>r(D)>r(C) | B. | 离子半径:r(C3-)>r(D-)>r(B+)>r(A2+) | ||
| C. | 原子序数:d>c>b>a | D. | 单质的还原性:A>B>D>C |
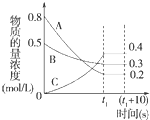 在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题:
在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题: 2C.
2C.