题目内容
【题目】为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。

实验操作 | 实验现象 |
i.打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
ii.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
iii.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)C中产生的白色沉淀是______。
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2。
①乙同学认为不能得出此结论,对实验进行了改进:
打开弹簧夹,通入N2,待排净装置内空气后,关闭弹簧夹,再打开A中分液漏斗活塞,此操作的目的是_________________
②丙同学进行了进一步的改进:
在B和C之间增加盛放CCl4的洗气瓶D,丙同学的目的是______
③将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:
氧化性H2O2>SO2。试写出两者反应的化学方程式________________
(3)iii中滴入少量H2O2没有明显变化。提出假设:
观点1:H2O2的量少不能氧化Br-
观点2:B中有未反应H2SO3(或SO2)
为验证观点2,应进行的实验操作及现象是______。
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是______。
【答案】BaSO4 除尽装置内的空气 除去挥发的溴蒸气 H2O2+SO2=H2SO4 取少量滴加H2O2溶液前的B中溶液于试管中,加热,将气体通入品红溶液中,品红溶液褪色 H2O2>Br2>SO2
【解析】
(1) 取C中沉淀加入盐酸,C中沉淀不溶解,说明生成硫酸钡,化学式为BaSO4;
(2)①由于在装置中含有空气,空气中的氧气和SO2在溶液中也会发生反应将其氧化,所以乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作就是:打开弹簧夹,通入N2,除尽装置内的空气,待排净装置内空气后,关闭弹簧夹;
②由于溴单质有挥发性,溴单质也可以将SO2氧化产生同样的实验现象,所以丙同学认为还应该在B和C之间增加洗气瓶D,来除去挥发的溴蒸气,D中盛放的试剂是CCl4或苯或饱和NaHSO3溶液;
③氧化性H2O2>SO2,二者反应生成硫酸,反应方程式为H2O2+SO2=H2SO4;
(3)由于H2SO3不稳定,受热容易分解产生有漂白性的SO2,所以为验证观点2,应进行的实验操作及现象是:取少量滴加H2O2溶液前的B中溶液于试管中,加热,将气体通入品红溶液中,品红溶液褪色,则该观点正确;
(4)物质在发生氧化还原反应中,氧化性强的可以把氧化性弱的制取出来,所以通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是H2O2>Br2>SO2。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】如图所示,利用培养皿进行实验。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。
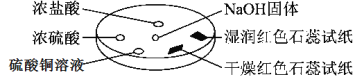
下表中对实验现象所做的解释不正确的是:
选项 | 实验现象 | 解释 |
A | 浓盐酸附近产生白烟 | NH3与HCl反应产生了NH4Cl固体 |
B | 浓硫酸附近无白烟 | NH3与浓硫酸不发生反应 |
C | 干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 | NH3与水反应生成了NH3·H2O,电离出OH-使红色石蕊试纸变蓝 |
D | 硫酸铜溶液变浑浊 | 生成Cu(OH)2沉淀 |
A. A B. B C. C D. D
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+===Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+===Cu+2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和碘单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
A. A B. B C. C D. D
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5流程:
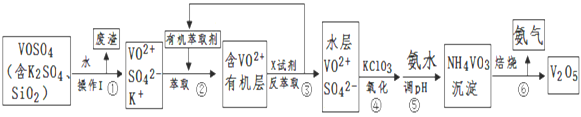
(1)步骤①所得废渣的成分是____________(写化学式),操作I的名称__________;
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n (水层)+ 2nHA(有机层)![]() 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是_____________________________;
③中X试剂为(写化学式)______________________________________;
(3)④的离子方程式为 ___________________________________________;
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为____________;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< _____________;(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有__________和_______________。