题目内容
【题目】同学们在实验室里用不同的方法分别制取Cu(NO3)2,并在此基础上探究Cu(NO3)2的化学性质。
(1)甲组同学直接用铜屑与稀硝酸反应制取Cu(NO3)2,反应的化学方程式是___。
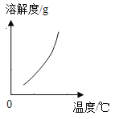
(2)乙组同学查阅了硝酸铜晶体的溶解度曲线(下图),据此设计了以下实验方案,先将铜粉在空气中充分灼烧,再将灼烧后的物质与适量稀HNO3反应,欲从反应后的溶液中得到Cu(NO3)2晶体,依次进行的操作是:蒸发浓缩、____________、过滤、洗涤、干燥。乙组同学认为此方案优于甲组的方案,理由之一是_____。
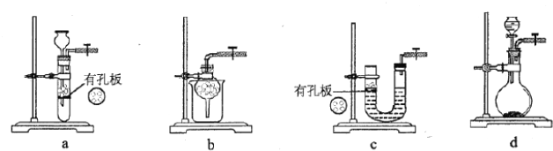
(3)丙组同学用Cu(NO3)2晶体,探究其热稳定性,实验装置如下所示。(夹持装置和加热仪器未画出)

①充分加热Cu(NO3)2晶体一段时间后,观察到U形管中气体变为红棕色,红棕色气体是____________。
②集气瓶中最终收集到的气体颜色是____________,U形管中进入集气瓶后颜色发生变化的原因是___。
③欲证明试管中残留的黑色粉末是CuO[假设Cu(NO3)2晶体已全部分解],实验方案是___。
④由该实验可得出的结论是___。
【答案】3Cu+8HNO3(稀)=3Cu(NO3)2 +2NO↑+4H2O 降温结晶 不会产生污染环境的 NO NO2 无色 3NO2 + H2O = 2 HNO3 + NO 取少量黑色粉末于试管中,向其中滴加足量稀硫酸,黑色粉末全部溶解,得到蓝色溶液 Cu(NO3)2 晶体的热稳定性较差
【解析】
(1)铜与稀硝酸反应生成硝酸铜、NO和水,据此书写;
(2)根据硝酸铜的溶解度与温度的关系分析判断;
(3)①根据气体的颜色判断气体的成分;
②二氧化氮溶于水生成硝酸和NO;
③根据氧化铜能溶于酸溶液中,溶液显蓝色分析判断;
④根据实验现象分析判断。
(1)甲组同学直接用铜屑与稀硝酸反应制取Cu(NO3)2,同时还有NO和水生成,反应的化学方程式是3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(2)根据图像可知硝酸铜的溶解度受温度影响较大,因此欲从反应后的溶液中得到Cu(NO3)2晶体,依次进行的操作是:蒸发浓缩、降温结晶、过滤、洗涤、干燥。先将铜粉在空气中充分灼烧,再将灼烧后的物质与适量稀HNO3反应,因此不会产生污染环境的NO,所以此方案优于甲组的方案。
(3)①充分加热Cu(NO3)2晶体一段时间后,观察到U形管中气体变为红棕色,因此红棕色气体是NO2。
②由于二氧化氮溶于水生成硝酸和一氧化氮,所以集气瓶中最终收集到的气体颜色是无色,二氧化氮进入集气瓶后颜色发生变化的原因是由于二氧化氮与水反应,方程式为3NO2+H2O=2HNO3+NO。
③氧化铜是碱性氧化物,能与酸反应,则欲证明试管中残留的黑色粉末是CuO[假设Cu(NO3)2晶体已全部分解]的实验方案是取少量黑色粉末于试管中,向其中滴加足量稀硫酸,黑色粉末全部溶解,得到蓝色溶液。
④根据以上分析可知,由该实验可得出的结论是Cu(NO3)2晶体的热稳定性较差。

【题目】下列物质的分类正确的是
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | CH3COOH | CaF2 | CO | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO2 |
A.AB.BC.CD.D
【题目】为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。

实验操作 | 实验现象 |
i.打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
ii.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
iii.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)C中产生的白色沉淀是______。
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2。
①乙同学认为不能得出此结论,对实验进行了改进:
打开弹簧夹,通入N2,待排净装置内空气后,关闭弹簧夹,再打开A中分液漏斗活塞,此操作的目的是_________________
②丙同学进行了进一步的改进:
在B和C之间增加盛放CCl4的洗气瓶D,丙同学的目的是______
③将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:
氧化性H2O2>SO2。试写出两者反应的化学方程式________________
(3)iii中滴入少量H2O2没有明显变化。提出假设:
观点1:H2O2的量少不能氧化Br-
观点2:B中有未反应H2SO3(或SO2)
为验证观点2,应进行的实验操作及现象是______。
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是______。