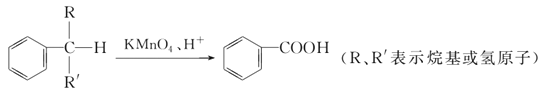
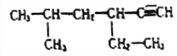题目内容
【题目】从海水中提取的粗盐含有Ca2+、Mg2+、SO42-等离子,为除去杂质离子可使用以下四种试剂:①Na2CO3溶液②BaCl2溶液③NaOH溶液④盐酸(用于沉淀的试剂均稍过量)。
![]()
(1)请在操作流程中填入合适的试剂编号_______、_______、______。
(2)加入过量NaOH溶液的目的是除去_______(填离子符号)。
(3)写出加入盐酸后溶液中发生主要反应的离子方程式_________、___________。
【答案】② ① ④ Mg2+ OH-+H+=H2O CO32-+2H+=CO2+H2O
【解析】
SO42-、Ca2+、Mg2+分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,以此解答该题。
(1)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,所以正确顺序为③②①④;
(2)加入过量NaOH溶液的目的是除去Mg2+;
(3)滤液中含有过量的碳酸钠和氢氧化钠。加入的盐酸可与碳酸钠、氢氧化钠反应,反应的离子方程式为OH-+H+=H2O、CO32-+2H+=CO2+H2O。

【题目】下列物质的分类正确的是
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | CH3COOH | CaF2 | CO | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO2 |
A.AB.BC.CD.D
【题目】为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。

实验操作 | 实验现象 |
i.打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
ii.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
iii.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)C中产生的白色沉淀是______。
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2。
①乙同学认为不能得出此结论,对实验进行了改进:
打开弹簧夹,通入N2,待排净装置内空气后,关闭弹簧夹,再打开A中分液漏斗活塞,此操作的目的是_________________
②丙同学进行了进一步的改进:
在B和C之间增加盛放CCl4的洗气瓶D,丙同学的目的是______
③将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:
氧化性H2O2>SO2。试写出两者反应的化学方程式________________
(3)iii中滴入少量H2O2没有明显变化。提出假设:
观点1:H2O2的量少不能氧化Br-
观点2:B中有未反应H2SO3(或SO2)
为验证观点2,应进行的实验操作及现象是______。
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是______。