题目内容
17.设NA为阿伏加德常数,下列叙述正确的是( )| A. | 1L0.1mol•L-1碳酸钠溶液中的阴离子总数为0.1NA | |
| B. | 将400mL1mol/L的HNO3溶液与7gFe粉充分反应,电子转移数为0.375NA | |
| C. | 标准状况下,14g氦气中共用电子对的数目为1.5NA | |
| D. | 已知反应N2(g)+3H2(g)?2NH3(g)△H=-91.8kJ/mol的转化率为30%,当放出91.8kJ热量时,生成氨分子的数目为0.6NA |
分析 A.碳酸根离子部分水解,导致溶液中阴离子总数增大;
B.7g铁的物质的量为0.125mol,根据n=cV计算出硝酸的物质的量,然后根据反应Fe+4H++NO3-=Fe3++NO↑+2H2O判断铁粉完全转化成铁离子时消耗硝酸的物质的量,从而得出硝酸不足,转移的电子小于0.375mol;
C.氮气分子中含有3对共用电子对,14g氮气的物质的量为0.5mol,含有1.5mol共用电子对;
D.根据热化学方程式可知,放出91.8 kJ热量时会生成2mol氨气
解答 解:A.1L 0.1 mol•L-1碳酸钠溶液中含有溶质碳酸钠0.1mol,由于碳酸根离子部分水解,导致溶液中阴离子数目增大,则溶液中含有的阴离子的物质的量大于0.1mol,含有的阴离子总数大于0.1NA,故A错误;
B.400 mL 1 mol/L的HNO3溶液中含有0.4mol硝酸,7gFe粉的物质的量为:$\frac{7g}{56g/mol}$=0.125mol,0.125mol铁粉完全反应生成铁离子时转移0.375mol电子,根据离子方程式Fe+4H++NO3-=Fe3++NO↑+2H2O可知,0.125mol铁粉完全反应生成铁离子需要消耗硝酸的物质的量为:0.125mol×4=0.5mol,显然硝酸不足,转移的电子小于0.375mol,故B错误;
C.14g氮气的物质的量为0.5mol,0.5mol氮气中含有1.5mol共用电子对,共用电子对的数目为1.5NA,故C正确;
D.反应N2(g)+3H2(g)?2NH3(g)△H=-91.8KJ/mol中,放出91.8 kJ热量时会生成2mol氨气,生成氨分子的数目为2NA,故D错误;
故选C.
点评 本题考查了物质的量的有关计算,难度不大,应注意的是物质的结构特点和公式的应用.

| A. | 酸性高锰酸钾溶液 | B. | 浓溴水 | ||
| C. | 氯化铁溶液 | D. | 氢氧化钠溶液 |
| A. | 有溶质析出 | B. | 溶液中Ca2+的数目不变 | ||
| C. | 溶剂的质量减小 | D. | 溶液的pH不变 |
| A. | 常温下,CH3COONH4溶液的pH=7,与纯水中H2O的电离程度相同 | |
| B. | 向CH3COONH4溶液加入CH3COONa固体时,c(NH4+)、c(CH3COO-)均会增大 | |
| C. | 常温下,等浓度的NH4Cl和CH3COONa两溶液的pH之和为14 | |
| D. | 等温等浓度的氨水和醋酸两溶液加水稀释到相同体积,溶液pH的变化值一定相同 |
| A. | 为了使燃料充分燃烧,通入的空气要适当过量 | |
| B. | 目前锅炉燃烧采用沸腾炉的逐渐增多,目的是提高煤炭的热效率并减少SO2的排放 | |
| C. | 为提高热能的利用率,可以在煤燃烧后排放废气的烟道中安装热交换装置 | |
| D. | 为开发氢能,可研究设法将太阳能聚焦,产生高温使水分解产生氢气 |
| A. | 通式相同的两种有机物按不同比例混合时,只要总质量一定,完全燃烧的耗氧量就一定 | |
| B. | 除去甲烷中的乙烯可用溴水或酸性高锰酸钾溶液 | |
| C. | 糖类、油脂、蛋白质都会在一定条件下水解 | |
| D. | 戊烷有3种同分异构体,而一氯戊烷有8种同分异构体 |
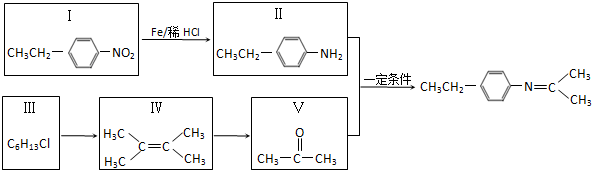
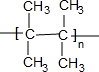 .
.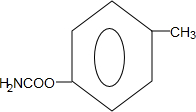 (写出一种).
(写出一种).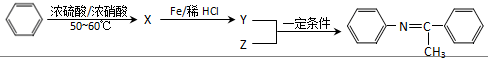
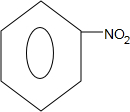 ,Z的结构简式为
,Z的结构简式为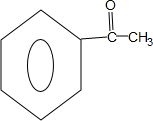 .
.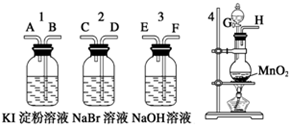 为了比较卤素单质的氧化性强弱,可在实验室先制取Cl2,并将Cl2依次通入NaBr溶液和淀粉KI溶液中.有如图所示的仪器(橡胶塞均为双孔)及药品,试回答:
为了比较卤素单质的氧化性强弱,可在实验室先制取Cl2,并将Cl2依次通入NaBr溶液和淀粉KI溶液中.有如图所示的仪器(橡胶塞均为双孔)及药品,试回答: