题目内容
10.在高温高压的水溶液中,AuS-与Fe2+发生反应沉积出磁铁矿(主要成分Fe3O4)和金矿(含Au),并伴有H2S气体生成.对于该反应的说法一定正确的是( )| A. | 氧化剂和还原剂的物质的量之比2:3 | |
| B. | AuS-既作氧化剂又作还原剂 | |
| C. | 每生成2.24 L气体,转移电子数为0.1mol | |
| D. | 反应后溶液的pH值降低 |
分析 根据在高温高压的水溶液中,AuS-与Fe2+发生反应沉积出磁铁矿(主要成分Fe3O4)和金矿(含Au),并伴有H2S气体生成,则发生的反应为2AuS-+3Fe2++4H2O$\frac{\underline{\;高温高压\;}}{\;}$Fe3O4+2Au+2H2S↑+4H+,其中AuS-中Au化合价降低为氧化剂,Fe2+化合价升高为还原剂,据此分析解答;
解答 解:根据在高温高压的水溶液中,AuS-与Fe2+发生反应沉积出磁铁矿(主要成分Fe3O4)和金矿(含Au),并伴有H2S气体生成,则发生的反应为2AuS-+3Fe2++4H2O$\frac{\underline{\;高温高压\;}}{\;}$Fe3O4+2Au+2H2S↑+4H+,其中AuS-中Au化合价降低为氧化剂,Fe2+化合价升高为还原剂,
A、根据以上分析,AuS-中Au化合价降低为氧化剂,Fe2+化合价升高为还原剂,又3mol二价铁参与反应,生成1molFe3O4,四氧化三铁可看作Fe2O3•FeO,所以只有2mol二价铁作为还原剂,所以氧化剂和还原剂的物质的量之比2:2=1:1,故A错误;
B、AuS-中Au化合价降低只作氧化剂,故B错误;
C、未标明标况,体积无法计算,故C错误;
D、根据反应方程式2AuS-+3Fe2++4H2O$\frac{\underline{\;高温高压\;}}{\;}$Fe3O4+2Au+2H2S↑+4H+,生成氢离子,所以反应后溶液的pH值降低,故D正确;
故选:D;
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,注意利用元素的化合价来分析氧化还原反应,明确反应中各物质中的元素的化合价是解答的关键.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
20.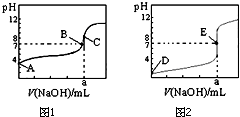 如图1、2为常温下用0.10mol•L-1 NaOH溶液滴定20.00mL 0.10mol•L-1 盐酸和20.00mL 0.10mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法正确的是( )
如图1、2为常温下用0.10mol•L-1 NaOH溶液滴定20.00mL 0.10mol•L-1 盐酸和20.00mL 0.10mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法正确的是( )
 如图1、2为常温下用0.10mol•L-1 NaOH溶液滴定20.00mL 0.10mol•L-1 盐酸和20.00mL 0.10mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法正确的是( )
如图1、2为常温下用0.10mol•L-1 NaOH溶液滴定20.00mL 0.10mol•L-1 盐酸和20.00mL 0.10mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法正确的是( )| A. | 图1是滴定盐酸的曲线 | |
| B. | E点时溶液中离子浓度为c(Na+ )=c(A- ) | |
| C. | B点时,反应消耗溶液体积:V(NaOH)>V(HA) | |
| D. | 当0mL<V(NaOH)<20.00mL时,溶液中一定是c(A-)>c(Na+ )>c(H+ )>c(OH- ) |
1.稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17 种元素.回答下列问题;
(1)钪(Sc)元素的原子核外电子排布式为1s22s22p63s23p63d14s2.钬(Ho)的基态原子电子排布式为[Xe]4f116s2,一个基态钛原子所含的未成对电子数为2.
(2)稀土元素最常见的化合价为+3价,但也有少数还有+4价.请根据下表中的电离能数据判断表中最有可能有+4价的元素是Ce.
几种稀土元素的电离能(单位:kJ•mol-1)
(3)离子化合物 Na3[Sc(OH)6]中,存在的作用力除离子键外还有共价键和配位键.
(4)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2.ICH2CH2I中碳原子杂化轨道类型为sp3,1mol CH2=CH2中含有的σ键数目为5NA.
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点.则PrO2(二氧化镨)的晶胞中有8个氧原子.
(6)Ce(铈)单质为面心立方晶体,晶胞参数为a=516pm.晶胞中Ce(铈)原子的配位数为12,列式表示Ce(铈)单质的密度:$\frac{4×140}{6.02×1{0}^{23}×(516×1{0}^{-10}){\;}^{3}}$g•cm-3(不必计算出结果)
(1)钪(Sc)元素的原子核外电子排布式为1s22s22p63s23p63d14s2.钬(Ho)的基态原子电子排布式为[Xe]4f116s2,一个基态钛原子所含的未成对电子数为2.
(2)稀土元素最常见的化合价为+3价,但也有少数还有+4价.请根据下表中的电离能数据判断表中最有可能有+4价的元素是Ce.
几种稀土元素的电离能(单位:kJ•mol-1)
| 元素 | I1 | I2 | I3 | I1+I2+I3 | I4 |
| Sc(钪) | 633 | 1235 | 2389 | 4257 | 7019 |
| Y(钇) | 616 | 1181 | 1980 | 3777 | 5963 |
| La(镧) | 538 | 1067 | 1850 | 3455 | 4819 |
| Ce(铈) | 527 | 1047 | 1949 | 3523 | 3547 |
(4)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2.ICH2CH2I中碳原子杂化轨道类型为sp3,1mol CH2=CH2中含有的σ键数目为5NA.
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点.则PrO2(二氧化镨)的晶胞中有8个氧原子.
(6)Ce(铈)单质为面心立方晶体,晶胞参数为a=516pm.晶胞中Ce(铈)原子的配位数为12,列式表示Ce(铈)单质的密度:$\frac{4×140}{6.02×1{0}^{23}×(516×1{0}^{-10}){\;}^{3}}$g•cm-3(不必计算出结果)
18.含不溶杂质的NaN03样品,加入一定量蒸馏水使其充分溶解,情况如表:
NaNO3溶解度(g/100g水)如表:
(1)实验中加入的水为300g;
(2)原样品中NaN03为372g.
| 温度(℃) | 10 | 40 | 75 |
| 剩余固体质量(g) | 201 | 132 | 72 |
| 温度(℃) | 10 | 40 | 75 |
| 溶解度 | 81 | 104 | 150 |
(2)原样品中NaN03为372g.
5.常温下,往饱和石灰水中加入一定量的生石灰,一段时间后恢复到原温度,以下叙述错误的是( )
| A. | 有溶质析出 | B. | 溶液中Ca2+的数目不变 | ||
| C. | 溶剂的质量减小 | D. | 溶液的pH不变 |
19.下列对有关元素的叙述能说明该元素一定是主族元素的是( )
| A. | N层比M层少8个电子的元素 | B. | L层比M层多一个电子的元素 | ||
| C. | 最高价为+6价的元素 | D. | 无负化合价的元素 |
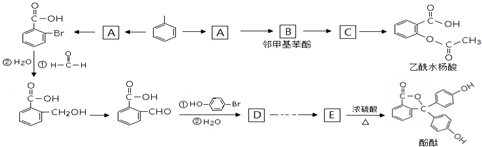
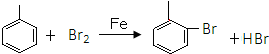 .
.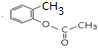 ,E分子中的含氧官能团名称为羧基、羟基;
,E分子中的含氧官能团名称为羧基、羟基;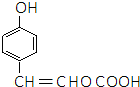 或
或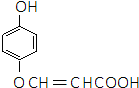 的邻、间、对的任意一种.
的邻、间、对的任意一种.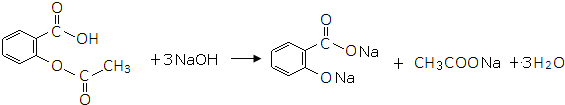 .
.