题目内容
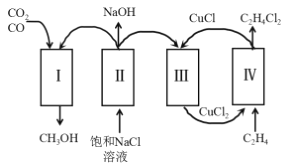
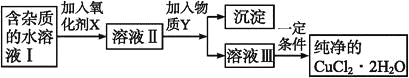
【题目】在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
已知某温度下:Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)加入氧化剂X的目的是_______________________。
(2)最适合作氧化剂X的是___________(填编号,否则不给分);写出氧化剂X参与的离子反应方程式_________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)为了除去Fe3+,需加入物质Y_________(填化学式)调节溶液的pH值为___________。
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________(填“能”或“不能”);若能,不用回答;若不能,回答该如何操作?____________________。
(5)常温下已知Fe(OH)3的Ksp=1.0×10-35,向500mL 0.2mol/L的FeCl3溶液中加入NaOH固体(溶液体积变化忽略不计)后pH=3.0,则需要加入氢氧化钠固体的质量为________g。
【答案】将Fe2+氧化成Fe3+,便于生成Fe(OH)3沉淀而与Cu2+分离 C H2O2+ 2Fe2++ 2H+= 2Fe3++ 2H2O CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3中的一种 不能 3.2-4.7 滤液中加盐酸或在HCl气流中,加热浓缩,冷却结晶,过滤 11.4
【解析】
氯化亚铁和氯化铜的混合液中,加入氧化剂可以将亚铁离子氧化为铁离子,调节pH可以将铁离子沉淀,得到氯化铜的水溶液,然后再酸性环境下蒸发浓缩、冷却结晶,过滤、洗涤、干燥即可得到氯化铜晶体。
(1)根据框图,Fe2+沉淀为氢氧化物时所需pH与Cu2+的沉淀的pH相同,也就是说,Fe2+沉淀的同时,Cu2+也会沉淀,无法将两者分离开,根据题干提供信息可知Fe3+沉淀所需的pH较小,所以应先将Fe2+氧化为Fe3+后再将其除去,加入氧化剂X可把Fe2+氧化为Fe3+,便于生成Fe(OH)3沉淀而与Cu2+分离;
(2)由于没有增加新杂质,所以X为H2O2,反应的离子方程式为H2O2+ 2Fe2++ 2H+= 2Fe3++ 2H2O;
(3)由于不能引入新的杂质,则为了除去Fe3+,需加入物质Y为CuO或Cu(OH)2或CuCO3会Cu2(OH)2CO3等;结合题示,调节pH=3.2~4.7,使Fe3+全部沉淀;
(4)CuCl2属于强酸弱碱盐,加热蒸发时促进其水解(HCl易挥发),所以应在HCl或SOCl2等混合液气氛中采用加热蒸发结晶的方法,以得到CuCl22H2O的晶体;
(5)设需要加入氢氧化钠的物质的量是x mol,则消耗氯化铁是![]() ,所以剩余氯化铁的物质的量是0.1mol-
,所以剩余氯化铁的物质的量是0.1mol-![]() ,则有
,则有 ,解得x=0.285,则氢氧化钠的质量是0.285mol×40g/mol=11.4g。
,解得x=0.285,则氢氧化钠的质量是0.285mol×40g/mol=11.4g。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
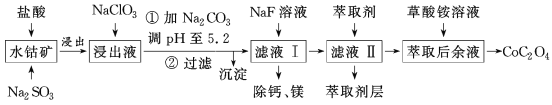
全优测试卷系列答案【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如图所示。
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
金属离子 | Fe3+ | Fe2+ | Co2+ | Al3+ | Mn2+ |
沉淀完全的pH | 2.8 | 8.3 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是___。
(2)写出加入NaClO3后发生反应的离子方程式__,检验离子是否反应完全的试剂是__(写试剂名称)。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。

滤液Ⅱ中加入萃取剂的作用是___,使用萃取剂适宜的pH是___(填序号)。
A.接近2.0 B.接近3.0 C.接近5.0
(4)除“钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液中![]() =__。
=__。
(5)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离常数Kb=1.8×10-5,H2SO3的电离常数Ka1=1.2×10-2,Ka2=1.3×10-8。在通入废气的过程中:当恰好形成正盐时,溶液中离子浓度的大小关系为__,当恰好形成酸式盐时,加入少量NaOH溶液,反应的离子方程式为__。