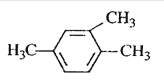
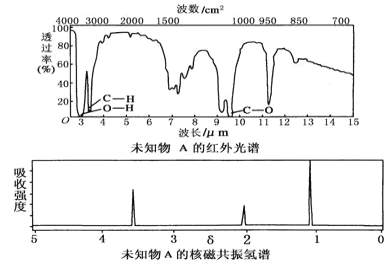
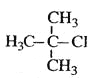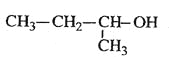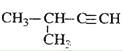��Ŀ����
����Ŀ��I.��1��25��ʱ��10Lˮ�к�H���ĸ���Ϊ________��(�谢���ӵ�����ΪNA����ͬ��)��1gˮ�к�H���ĸ���Ϊ________����
��2��ij�¶�(t��)ʱ��ˮ��Kw��1��10-12������¶�________25��(����>����<����������)�����¶��£�c(H��)��1��10-7mol��L��1����Һ��________(����������������������������)��������Һ��ֻ����NaOH���ʣ�����H2O���������c(OH��)��________mol��L��1��
II.�Ȼ�����Ҫ���ڽ���ʴ�̡���ˮ����������Ч���á��۸���˵��ŵ㡣��ش������й��Ȼ��������⣺
��1����FeCl3����ˮ����ԭ���û�ѧ�������Ϊ________������FeCl3��Һʱ��Ҫ����������Ũ���ᣬ������Ϊ________��
��2��25��ʱ��Ksp[Fe(OH)3]��4.0��10��38��Fe3������ˮ�ⷴӦFe3����3H2O![]() Fe(OH)3��3H�����÷�Ӧ��ƽ�ⳣ��Ϊ______________��
Fe(OH)3��3H�����÷�Ӧ��ƽ�ⳣ��Ϊ______________��
���𰸡�10��6NA 10��10NA > ���� 1��10��7 Fe3+��3H2O![]() Fe(OH)3(����)��3H+ ��ֹFe3+ˮ��ʹ��Һ���� 2.5��10��5
Fe(OH)3(����)��3H+ ��ֹFe3+ˮ��ʹ��Һ���� 2.5��10��5
��������
I.��1��25��ʱ��10Lˮ�������ӵ����ʵ�����10��7mol��L��1��10L��10��6mol����H���ĸ���Ϊ10��6NA��1gˮ�����Լ��1mL�����к�H���ĸ���Ϊ10��10NA����
��2��ij�¶�(t��)ʱ��ˮ��Kw��1��10-12���������ȣ������¶ȴٽ����룬����¶ȣ�25�棬���¶��£�c(H��)��1��10-7mol��L��1��1��10-6mol��L��1��������Һ�ʼ��ԣ�������Һ��ֻ����NaOH���ʣ�����ˮ�ĵ��룬����H2O���������c(OH��)��c(H��)��1��10-7mol��L��1��
II.��1��������ˮ������������������ɾ�ˮ������FeCl3����ˮ����ԭ���û�ѧ�������ΪFe3+��3H2O![]() Fe(OH)3(����)��3H+������������ˮ����������������Ϊ��ֹFe3+ˮ��ʹ��Һ���ǣ��������FeCl3��Һʱ��Ҫ����������Ũ���
Fe(OH)3(����)��3H+������������ˮ����������������Ϊ��ֹFe3+ˮ��ʹ��Һ���ǣ��������FeCl3��Һʱ��Ҫ����������Ũ���
��2��25��ʱ��Ksp[Fe(OH)3]��4.0��10��38��Fe3������ˮ�ⷴӦFe3����3H2O![]() Fe(OH)3��3H�����÷�Ӧ��ƽ�ⳣ��Ϊ
Fe(OH)3��3H�����÷�Ӧ��ƽ�ⳣ��Ϊ![]() 2.5��10��5��
2.5��10��5��

����Ŀ��ij̽����ѧϰС����������к͵ζ����ⶨ���۰״�������(g��100mL��1)���йز������£�
��.ʵ�鲽��
��1����________(����������)��ȡ10.00mLʳ�ð״ף����ձ�����ˮϡ�ͺ�ת�Ƶ�100mL����ƿ�ж��ݣ�ҡ�ȼ��ô���״���Һ��
��2������ʽ�ζ���ȡ����״���Һ20.00mL����ƿ�У������еμ�2��________��ָʾ����
��3����ȡʢװ0.1000mol��L��1NaOH��Һ�ļ�ʽ�ζ��ܵij�ʼ���������Һ��λ����ͼ��ʾ�����ʱ�Ķ���Ϊ________mL��
![]()
��4���ζ�����__________________________________________________ʱ��ֹͣ�ζ�������¼NaOH��Һ���ն������ظ��ζ�3�Ρ�
��.ʵ���¼
�ζ�����ʵ������(mL) | 1 | 2 | 3 | 4 |
V(��Ʒ) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(����) | 15.95 | 15.00 | 15.05 | 14.95 |
��.���ݴ���������
��1���������ݿɵã�c(���۰״�)��________mol��L��1�����۰״���������________g��100mL��1��
��2���ڱ�ʵ��ĵζ������У����в�����ʹʵ����ƫ�����________��д���)��
a����ʽ�ζ����ڵζ�ʱδ�ñ�NaOH��Һ��ϴ
b����ʽ�ζ��ܵļ����ڵζ�ǰ�����ݣ��ζ���������ʧ
c����ƿ�м������״���Һ���ټ�����ˮ
d����ƿ�ڵζ�ʱ����ҡ����������Һ�彦��
����Ŀ��������������ᴿ�У����������ܵ���ʵ��ܽ�ƽ��ԭ����ȥijЩ�������ӡ����к��Ȼ��������ʵ��Ȼ�ͭ����(CuCl2��2H2O)��Ϊ��ȡ������CuCl2��2H2O�����Ƚ����Ƴ�ˮ��Һ��Ȼ����ͼ��������ᴿ��
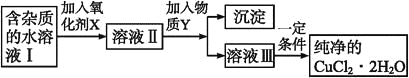
��֪ij�¶��£�Cu2+��Fe3+��Fe2+���������↑ʼ�����ͳ�����ȫʱ��pH�����±���
Fe3+ | Fe2+ | Cu2+ | |
�������↑ʼ����ʱ��pH | 1.9 | 7.0 | 4.7 |
����������ȫ����ʱ��pH | 3.2 | 9.0 | 6.7 |
��ش��������⣺
��1������������X��Ŀ����_______________________��
��2�����ʺ���������X����___________�����ţ������֣���д��������X��������ӷ�Ӧ����ʽ_________��
A��K2Cr2O7 B��NaClO C��H2O2 D��KMnO4
��3��Ϊ�˳�ȥFe3+�����������Y_________���ѧʽ��������Һ��pHֵΪ___________��
��4������ܲ���ֱ�������ᾧ�õ�CuCl2��2H2O���壿________(������������������)�����ܣ����ûش������ܣ��ش����β�����____________________��
��5����������֪Fe(OH)3��Ksp=1.0��10-35����500mL 0.2mol/L��FeCl3��Һ�м���NaOH����(��Һ����仯���Բ���)��pH=3.0������Ҫ�����������ƹ��������Ϊ________g��