题目内容
【题目】欲使0.1mol·L-1的NaHCO3溶液中c(H+)、c(HCO3-)都减少而c(CO32-)增大,其方法是
A.通入二氧化碳气体B.加入适量氢氧化钠固体
C.通入氯化氢气体D.加入饱和石灰水溶液
【答案】B
【解析】
A.CO2+H2O![]() H2CO3,抑制碳酸氢钠的水解,溶液的碱性减小,氢离子和碳酸氢根离子浓度都增大,故A错误;
H2CO3,抑制碳酸氢钠的水解,溶液的碱性减小,氢离子和碳酸氢根离子浓度都增大,故A错误;
B.NaHCO3+NaOH=Na2CO3+H2O,所以加入氢氧化钠固体后,碳酸氢根离子浓度减小,碳酸根离子浓度增大,氢离子浓度减小,故B正确;
C.HCl+NaHCO3=NaCl+H2O+CO2↑,所以通入氯化氢气体后,碳酸氢根离子浓度减小,碳酸根离子浓度减小,碳酸氢钠溶液呈碱性,通入氯化氢后溶液碱性减弱,所以氢离子浓度增大,故C错误;
D.Ca(OH)2+NaHCO3=CaCO3↓+H2O+NaOH,加入饱和石灰水溶液后,碳酸氢根离子转化为碳酸钙沉淀,所以碳酸氢根离子浓度、碳酸根离子浓度都减小,溶液由弱碱性变为强碱性,所以氢离子浓度也减小,故D错误;
故答案选B。

 培优好卷单元加期末卷系列答案
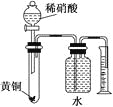
培优好卷单元加期末卷系列答案【题目】实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2= CH2
CH2= CH2![]() CH2=CH2+Br2
CH2=CH2+Br2![]() Br2CH2CH2Br
Br2CH2CH2Br
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示:

有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是______;
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入________,其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_______层(填“上”、“下”);
(4)若产物中有少量副产物乙醚.可用_____________的方法除去。
(5)下列关于装置的说法正确的是___________________________;
a.图中仪器a的侧面导管有利于液体顺利滴落
b.B的长导管可防止反应出现堵塞情况
c.B有防倒吸作用
(6)以1,2—二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2—二溴乙烷通过( ① )反应制得( ② ),②通过( ③ )反应制得氯乙烯,由氯乙烯制得聚氯乙烯。
①______________(填反应类型)
②________________(填该物质的电子式)
③______________(填反应类型)写出第一步的化学方程式_________________。
【题目】在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
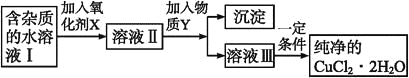
已知某温度下:Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)加入氧化剂X的目的是_______________________。
(2)最适合作氧化剂X的是___________(填编号,否则不给分);写出氧化剂X参与的离子反应方程式_________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)为了除去Fe3+,需加入物质Y_________(填化学式)调节溶液的pH值为___________。
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________(填“能”或“不能”);若能,不用回答;若不能,回答该如何操作?____________________。
(5)常温下已知Fe(OH)3的Ksp=1.0×10-35,向500mL 0.2mol/L的FeCl3溶液中加入NaOH固体(溶液体积变化忽略不计)后pH=3.0,则需要加入氢氧化钠固体的质量为________g。