题目内容
【题目】氟磷灰石是常见的钙氟磷酸盐矿物,其化学式为Ca5(PO4)3F,由氟磷灰石制取黄磷(P4)的化学式为4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g),请回答下列问题:
(1)基态Ca原子电子所占据最高能级的电子云轮廓图为________,基态P原子的价电子轨道表达式为________。
(2)由氟磷灰石制取黄磷(P4)产物中属于极性分子的化合物是________,与其互为等电子体的分子为________。
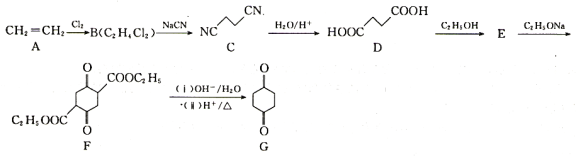
(3)黄磷(P4)晶体的空间结构如图甲所示,P的杂化轨道类型为________,磷的一种硫化物P4S3的空间结构如图乙所示,每个S原子中含有孤电子对的数目为________。

(4)SiO2的沸点________(填“大于”或“小于”)CO2的沸点,其原因为________。
(5)Ca与Ti、O元素形成的化合物的晶胞结构如图所示,则该晶体的化学式为________,若晶胞密度为ρgcm-3,阿伏加德罗常数的值为NA,则该晶胞中两个距离最近的O原子之间的距离为________pm(用含ρ、NA的表达式表示)。

【答案】球形 ![]() CO N2 sp3杂化 2 大于 SiO2为原子晶体,CO2为分子晶体,原子晶体的熔沸点比分子晶体的熔沸点高 CaTiO3
CO N2 sp3杂化 2 大于 SiO2为原子晶体,CO2为分子晶体,原子晶体的熔沸点比分子晶体的熔沸点高 CaTiO3 ![]()
【解析】
(1)基态Ca原子的价电子排布式为4s2,电子所占据最高能级为4s;基态P原子的价电子排布式为3s23p3。
(2)由氟磷灰石制取黄磷(P4)产物中P4、SiF4为非极性分子,CaSiO3为离子化合物,CO为极性分子,若两种离子或分子含有相同的原子数和价电子总数则互为等电子体。
(3)根据价层电子互斥理论进行判断。
(4)原子晶体的熔沸点比分子晶体的熔沸点高。
(5)根据“均摊法”进行计算。
(1)基态Ca原子的价电子排布式为4s2,电子所占据最高能级为4s,其电子云轮廓图为球形,基态P原子的价电子排布式为3s23p3,其价电子轨道表达式也就是价电子排布图为![]() 。
。
(2)由氟磷灰石制取黄磷(P4)产物中P4、SiF4为非极性分子,CaSiO3为离子化合物,CO为极性分子,若两种离子或分子含有相同的原子数和价电子总数则互为等电子体,故与CO互为等电子体的分子为N2。
(3)黄磷(P4)晶体的空间构型为正四面体,每个P原子含有的价层电子对数为3+(5-3)÷2=4,故P原子的杂化轨道类型为sp3杂化,P4S3中每个S原子与两个P原子以单键相连,S原子的价层电子对数为2+(6-2)÷2=4,故S原子有两对成键电子对和两对孤电子对。
(4)SiO2的沸点大于CO2的沸点,其原因为SiO2为原子晶体,CO2为分子晶体,原子晶体的熔沸点比分子晶体的熔沸点高。
(5)根据“均摊法”可知,该晶胞中含有1个Ca2+、1个Ti4+和3个O2-,故其化学式为CaTiO3,设该晶胞参数为acm,则有![]() ,
,![]() ,两个最近的O原子之间的距离为
,两个最近的O原子之间的距离为![]() 单位换算可知结果为
单位换算可知结果为![]() 。
。

【题目】在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
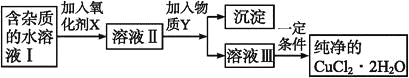
已知某温度下:Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)加入氧化剂X的目的是_______________________。
(2)最适合作氧化剂X的是___________(填编号,否则不给分);写出氧化剂X参与的离子反应方程式_________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)为了除去Fe3+,需加入物质Y_________(填化学式)调节溶液的pH值为___________。
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________(填“能”或“不能”);若能,不用回答;若不能,回答该如何操作?____________________。
(5)常温下已知Fe(OH)3的Ksp=1.0×10-35,向500mL 0.2mol/L的FeCl3溶液中加入NaOH固体(溶液体积变化忽略不计)后pH=3.0,则需要加入氢氧化钠固体的质量为________g。