题目内容
2.PM2.5(可入肺颗粒物)污染与能源使用的排放有关,SO2、NO2、氨气以及挥发性有机物都是污染性气体.旋转喷雾干燥法是去除燃煤烟气中二氧化硫的方法之一,工艺流程如图1所示:(1)写出高速旋转雾化器中发生反应的化学方程式2SO2+O2+2Ca(OH)2$\frac{\underline{\;催化剂\;}}{△}$2 CaSO4+2H2O.
(2)在一定条件下,SO2可被氧气氧化,每生成8gSO3气体,放出9.83kJ的热量.写出该反应的热化学方程式2SO2(g)+O2(g)=2SO3(g)△=-196.6kJ/mol.
(3)500℃时,在催化剂存在条件下,分别将2molSO2和1molO2置于恒压容器Ⅰ和恒容容器Ⅱ中(两容器起始容积均为2L),充分反应,二者均达到平衡后:
①两容器中SO3的体积分数关系是Ⅰ>Ⅱ(填“>”、“<”或“=”).若测得容器II中的压强减小了30%,则该温度下的化学平衡常数K=1620.
②t1时刻分别向两容器的平衡体系中加入2molSO3,则两容器中SO3的体积分数随时间变化曲线图图2正确的是A(填序号).
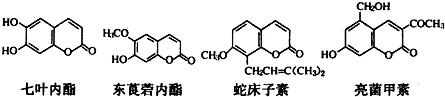
(4)用NaOH溶液吸取烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图3所示(电极材料为石墨).
①图中a极要连接电源的负极,C口流出的物质是硫酸(填名称).
②SO32-放电的电极反应式为SO32--2e-+H2O=SO42-+2H+.
③电解过程中阴极区碱性明显增强,请用平衡移动原理解释原因:H2O?H++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强.
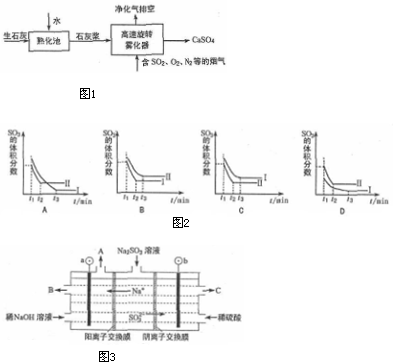
分析 (1)高速旋转雾化器中涉及反应为二氧化硫、氧气和氢氧化钙反应生成硫酸钙;
(2)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,根据每生成8g SO3气体,放出9.83kJ的热量,求出生成2molSO3气体放出的热量,据此写出燃烧热的化学方程式;
(3)①根据压强对化学平衡移动的影响知识来回答,反应体系中,压强之比等于物质的量之比,根据三段式计算平衡时各种物质的浓度,依据平衡常数表达式计算平衡常数;
②根据压强对速率和平衡影响分析,恒压容器I和恒容容器Ⅱ中,分别向两容器的平衡体系中加入2mol SO3,平衡逆向进行,气体的物质的量增大,恒压容器I的体积增大,恒容容器Ⅱ的体积不变压强增大,则容器Ⅱ的反应速率快达到平衡所用时间短,压强大平衡向生成SO3向进行,则容器Ⅱ中SO3含量高;
(4)①根据电解池中阴阳离子的移动方向:阳离子移向阴极可以判断①图中a极要连接电源的负极,SO32-在阳极失去电子变成SO42-,所以C口流出的物质是H2SO4;
②SO32-失去电子被氧化成SO42-;
③在阴极H+放电生成H2,c(H+)减小,水的电离平衡H2O?H++OH-正向移动,所以碱性增强.
解答 解:(1)高速旋转雾化器中涉及反应为二氧化硫、氧气和氢氧化钙反应生成硫酸钙,反应的方程式为:2SO2+O2+2Ca(OH)2$\frac{\underline{\;催化剂\;}}{△}$2 CaSO4+2H2O,
故答案为:2SO2+O2+2Ca(OH)2$\frac{\underline{\;催化剂\;}}{△}$2 CaSO4+2H2O;
(2)依据方程式2SO2(g)+O2(g)?2SO3(g),每生成8g 即0.1molSO3气体,放出9.83kJ的热量,则生成2molSO3气体放出的热量为196.6kJ,所以反应的热化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/molKJ•mol-1;
故答案为:2SO2(g)+O2(g)=2SO3(g)△=-196.6kJ/mol;
(3)①对于反应:2SO2(g)+O2(g)?2SO3(g),恒容容器相当于恒压容器的基础上加大压强,化学平衡正向移动,SO3的体积分数增大,所以Ⅰ>Ⅱ;将2mol SO2和1mol O2置于恒容容器II中,设容器中SO2的变化量为x,
2SO2(g)+O2(g)?2SO3(g)
初始量:2 1 0
变化量:x 0.5x x
平衡量:2-x 1-0.5x x
容器II中的压强减小了30%,$\frac{3}{2-x+1-0.5x+x}$=$\frac{1}{1-30%}$ 解得x=1.8mol;
则平衡时二氧化硫的物质的量为0.2mol,浓度为:$\frac{0.2mol}{2L}$=0.1mol/L;
氧气的物质的量为0.1mol,浓度为:$\frac{0.1mol}{2L}$=0.05mol/L;
三氧化硫的物质的物质的量为1.8mol,浓度为:$\frac{1.8mol}{2L}$=0.9mol/L;
平衡常数K=$\frac{{C}^{2}(S{O}_{3})}{{C}^{2}(S{O}_{2})C({O}_{2})}$=$\frac{0.9×0.9}{0.1×0.1×0.05}$=1620;
故答案为:1620;
②恒压容器I和恒容容器Ⅱ中,分别向两容器的平衡体系中加入2mol SO3,平衡逆向进行,气体的物质的量增大,恒压容器I的体积增大,恒容容器Ⅱ的体积不变压强增大,则容器Ⅱ的反应速率快达到平衡所用时间短,压强大平衡向生成SO3向进行,则容器Ⅱ中SO3含量高,所以图A符合,
故答案为:A;
(4)①根据电解池中阴阳离子的移动方向:阳离子移向阴极可以判断①图中a极要连接电源的负极,SO32-在阳极失去电子变成SO42-,所以C口流出的物质是H2SO4,
故答案为:负;硫酸;
②SO32-失去电子被氧化成SO42-,电极反应式为:SO32--2e-+H2O=SO42-+2H+,故答案为:SO32--2e-+H2O=SO42-+2H+;
③在阴极H+放电生成H2,c(H+)减小,水的电离平衡H2O?H++OH-正向移动,所以碱性增强,
故答案为:H2O?H++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强.
点评 本题考查了方程式的书写、平衡常数的计算、电解池工作原理,熟悉相关知识是解题关键,题目难度中等.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案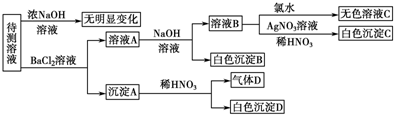
请回答下列问题:(1)根据上述框图信息填写下表(不能确定的不填):
| 肯定存在的离子 | 肯定没有的离子 | |
| 化学式或离子符号 |
(3)若Mn+位于第三周期,则要确定它具体是何种离子的方法是做焰色反应实验,观察到黄色火焰,则说明是钠.
| A. | 七叶内酯与东茛菪内酯互为同系物 | |
| B. | 四种化合物含有的官能团种类完全相同 | |
| C. | l mol上述四种物质与足量氢氧化钠溶液反应,消耗氢氧化钠最多的是亮菌甲素 | |
| D. | 它们都能使溴的四氯化碳溶液褪色 |
| A. | 甲、乙中铝都有剩余 | |
| B. | 铝片的质量是5.4 g | |
| C. | 盐酸或氢氧化钠的物质的量浓度为0.1 mol/L | |
| D. | 盐酸或氢氧化钠的物质的量浓度为0.2 mol/L |
| A | B | C | D | |
| 正极 | Fe | C | Cu | Zn |
| 负极 | Cu | Fe | Fe | Fe |
| 电解质溶液 | CuSO4 | H2SO4 | CuCl2 | CuSO4 |
| A. | A | B. | B | C. | C | D. | D |
 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )| A. | 柠檬烯的一氯代物有9种 | |
| B. | 柠檬烯和丁基苯(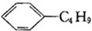 )互为同分异构体 )互为同分异构体 | |
| C. | 柠檬烯的分子中所有的碳原子可能在同一个平面上 | |
| D. | 一定条件下,柠檬烯可以发生加成、取代、氧化等反应 |
| A. | 金属钠着火时,可用水或泡沫灭火器灭火 | |
| B. | 碱金属单质都可保存在煤油中 | |
| C. | 钠离子核外电子数比钠原子核外电子数少 | |
| D. | 碱金属中密度最小,熔、沸点最高的是铯 |
