题目内容
【题目】某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应)。请回答下列问题:
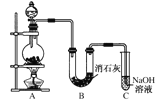
(1)A为实验室制氯气的发生装置,反应化学方程式为_________________________;某学生用12 mol·L-1的浓盐酸100 mL和足量的MnO2反应制Cl2,实际得到的Cl2________6.72 L(填“<”、“>”或“=”)。
(2)漂白粉将在U形管中产生,其化学方程式是_________________________________。
(3)此实验所得漂白粉的有效成分偏低。该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是________________。
②Cl2中含HCl,会发生反应2HCl+Ca(OH)2===CaCl2+2H2O,为避免此副反应的发生,可将装置作何改进______________________________。
(4) C装置的作用是________________________________。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O < 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 冷却B装置(或将B装置放在冷水浴中) 在A与B之间连接一个装有饱和氯化钠溶液的洗气瓶 吸收未反应完的氯气,防止污染空气
MnCl2+Cl2↑+2H2O < 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 冷却B装置(或将B装置放在冷水浴中) 在A与B之间连接一个装有饱和氯化钠溶液的洗气瓶 吸收未反应完的氯气,防止污染空气
【解析】
装置A制备氯气,氯气在与消石灰发生反应得到次氯酸钙,氯气有毒,用碱液吸收。
(1)实验室制氯气的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;二氧化锰和稀盐酸不反应,随着反应的进行,盐酸浓度变稀,用12 mol·L-1的浓盐酸100 mL和足量的MnO2反应制Cl2,实际得到的Cl2<6.72 L;
MnCl2+Cl2↑+2H2O;二氧化锰和稀盐酸不反应,随着反应的进行,盐酸浓度变稀,用12 mol·L-1的浓盐酸100 mL和足量的MnO2反应制Cl2,实际得到的Cl2<6.72 L;
(2)氢氧化钙与氯气反应的化学方程式是2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O;
(3)①氯气与氢氧化钙反应放热反应,温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是降低温度,将B装置放在冷水浴中;
②Cl2中含HCl,会发生反应2HCl+Ca(OH)2===CaCl2+2H2O,为避免此副反应的发生,先除去氯气中的氯化氢,可在A与B之间连接一个装有饱和氯化钠溶液的洗气瓶;
(4)氯气有毒,C装置的作用是吸收未反应完的氯气,防止污染空气。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
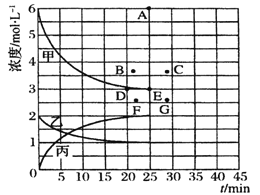
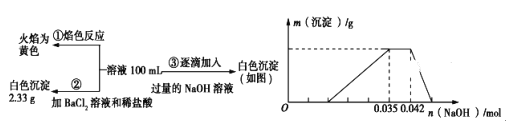
小学生10分钟应用题系列答案【题目】工业合成氨反应为Nz(g)+3H2(g) ![]() 2NH3(g),对其研究如下:在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1L 的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表;
2NH3(g),对其研究如下:在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1L 的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表;
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(1) 前10min 中利用N2表示的反应速率为________
(2) 该温度下,此反应的平衡常数K=__________
(3) 该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,则此时v正_______v逆(填“>”、“<”或“=”)。
(4) 该温度下,在上述平衡体系中再通入2molNH3,一段时间后,达到新的平衡。此时c(H2)____ 4.5mo1/L(填“>”、“<”或“=”)。
(5) 由上表中的实验数据计算得到“浓度-时间”的关系可用右图中的曲线表示,表示c(N2)-t的曲线是______。在此温度下,若起始充入4 mol Nz 和12 mol Hz,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_______。