题目内容
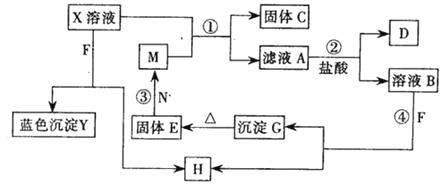
【题目】某金属加工厂排放的污水中含有CuSO4、ZnSO4、FeSO4,某研究小组利用该污水回收工业重要原料硫酸锌和有关金属,其流程如下:
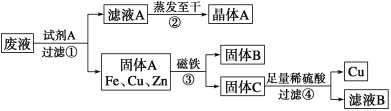
请回答下列问题:
(1)下列说法正确的是________。
A.该工艺流程中发生了3个置换反应
B.CuSO4与Mg(OH)2发生复分解反应可得Cu(OH)2
C.步骤①②③④都包含化学变化
(2)写出步骤①发生反应的离子方程式:__________________、_________________
(3)步骤④中加入足量稀硫酸的目的是________________
(4)滤液B含有的分散质为____________、___________ .
【答案】A Zn+Cu2+===Cu+Zn2+ Zn+Fe2+===Fe+Zn2+ 使Zn完全溶解 ZnSO4 H2SO4
【解析】
因金属的活泼性Zn>Fe>Cu,由废水中含有CuSO4,ZnSO4、FeSO4,则加入锌粉能发生锌与硫酸亚铁、锌与硫酸铜的反应,其反应分别为Zn+FeSO4═ZnSO4+Fe、Zn+CuSO4═ZnSO4+Cu,滤液A为ZnSO4溶液,蒸发得到硫酸锌晶体,固体A经磁铁将铁分离开,固体C中含有锌与铜,加足量稀硫酸时,铜并不反应经过滤可得到,而锌与稀硫酸发生化学反应,其反应为Zn+H2SO4═ZnSO4+H2↑,加入适量稀硫酸的目的是使锌完全转化为ZnSO4,以此解答该题。
(1)A.由以上分析可知发生的置换反应有Zn+FeSO4═ZnSO4+Fe、Zn+CuSO4═ZnSO4+Cu、Zn+H2SO4═ZnSO4+H2↑,正确;B.CuSO4与MgCl2不能发生复分解反应,错误;C.步骤②为物理过程,不涉及化学变化,错误;选A;
(2)步骤①发生反应为Zn+FeSO4═ZnSO4+Fe、Zn+CuSO4═ZnSO4+Cu,离子方程式为Zn+Cu2+=Cu+Zn2+、Zn+Fe2+=Zn2++Fe;
(3)加足量稀硫酸时,铜并不反应经过滤可得到,而锌与稀硫酸发生化学反应,其反应为Zn+H2SO4═ZnSO4+H2↑,加入适量稀硫酸的目的是使锌完全转化为ZnSO4,使Zn完全溶解;
(4) 固体C中含有锌与铜,加足量稀硫酸时,铜并不反应经过滤可得到,而锌与稀硫酸发生化学反应,其反应为Zn+H2SO4═ZnSO4+H2↑,加入适量稀硫酸的目的是使锌完全转化为ZnSO4,滤液B含有的分散质为ZnSO4和过量的H2SO4。