题目内容
16.相同条件下,有CO和CO2 两种气体,回答下列问题:(1)同质量的CO和CO2的体积比为11:7,分子个数比为11:7,密度比为7:11.
(2)两种气体体积相同,则CO和CO2的质量比为7:11,物质的量比为1:1.
分析 (1)根据n=$\frac{m}{M}$计算物质的量之比,相同条件下气体体积之比等于其物质的量之比;由根据N=nNA可知,分子数目之比等于其物质的量之比;相同条件下,气体密度之比等于其摩尔质量之比;
(2)相同条件下,气体体积相同,则气体物质的量相同,根据m=nM计算质量之比.
解答 解:(1)根据n=$\frac{m}{M}$可知,同质量的CO和CO2的物质的量之比为44g/mol:28g/mol=11:7,由V=nVm可知,相同条件下,二者体积之比为11:7;由根据N=nNA可知,二者分子数目之比为11:7;相同条件下,气体密度之比等于其摩尔质量之比,故二者密度之比为28g/mol:44g/mol=7:11,
故答案为:11:7;11:7;7:11;
(2)相同条件下,气体体积相同,则CO和CO2的物质的量之比为1:1,CO和CO2的质量比为28g/mol:44g/mol=7:11,
故答案为:7:11;1:1.
点评 本题考查物质的量有关计算,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
6.如图为铜-锌-稀硫酸构成的原电池示意图,下列说法正确的是( )
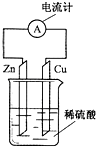

| A. | 锌片为正极,且锌片逐渐溶解 | B. | 铜片为负极,且铜片上有气泡 | ||
| C. | 溶液中的H+移向铜极 | D. | 该装置能将电能转变为化学能 |
7.下列表述正确的是( )
| A. | CO2的比例模型: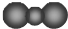 | |
| B. | 氢化铵(NH4H)电子式: | |
| C. | (CH3)3COH的名称:2,2-二甲基乙醇 | |
| D. | 乙酸乙酯的水解CH3COOCH2CH3+H218O $?_{△}^{酸}$CH3CO18OH+CH3CH2OH |
4.将100mL溶液中含硫酸0.01mol、硝酸0.04mol,若在该溶液中投入1.92g铜粉微热,反应后放出一氧化氮气体标准状况下体积约为( )
| A. | 0.448L | B. | 0.336L | C. | 0.224L | D. | 无法计算 |
9.下列各项正确的是( )
| 电极反应式 | 出现环境 | |
| A | O2+2H2O+4e-═4OH- | 碱性环境下氢氧燃料电池的负极反应 |
| B | 4OH--4e-═O2↑+2H2O | 弱酸性环境下钢铁的吸氧腐蚀 |
| C | 2H2O+2e-═H2↑+2OH- | 用Cu作电极电解NaOH溶液的阴极反应 |
| D | H2-2e-═2H+ | 用惰性电极电解H2SO4的阳极反应 |
| A. | A | B. | B | C. | C | D. | D |
6.能用一种试剂鉴别乙醛、乙酸、甲酸、苯、四氯化碳的是( )
| A. | 银氨溶液 | B. | 新制Cu(OH)2 | C. | FeCl3 | D. | 溴水 |
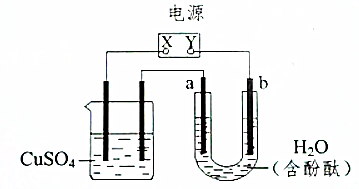 如图装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,回答下列问题:
如图装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,回答下列问题:
