题目内容
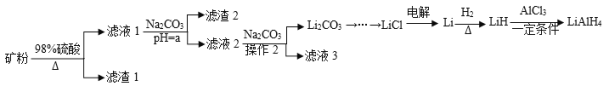
【题目】四氢铝锂(LiAlH4)常作为有机合成的重要还原剂。工业上以辉锂矿(主要成分是LiAlSi2O6,含少量Fe2O3)为原料合成四氢铝锂的流程如图:
已知:金属氢氧化物沉淀的pH如下表所示:
物质 | Fe(OH)3 | Al(OH)3 |
开始沉淀的pH | 2.3 | 4 |
完全沉淀的pH | 3.7 | 6.5 |
请回答:
(1)写出LiAlSi2O6与硫酸反应的化学方程式__。滤渣2的主要成分为__(填化学式),“a”的最小值为__。
(2)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系如下表所示。操作2中,蒸发浓缩后必须趁热过滤,其原因是__,90℃时Ksp(Li2CO3)的值为__。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/mol·L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(3)流程中由LiC1制备金属Li的电解条件是__。
(4)为测定制备的四氢铝锂(LiAlH4)的纯度,称取样品ag加入水使其完全反应后,收集到标况下气体VmL,
①LiAlH4溶解时发生反应的化学方程式为__。
②样品的纯度为__(列出数学表达式即可)。
【答案】2LiAlSi2O6+4H2SO4=Li2SO4+Al2(SO4)3+4H2SiO3↓ Fe(OH)3、Al(OH)3 6.5 Li2CO3溶解度随温度升髙而降低,蒸发浓缩后趁热过滤,能减少Li2CO3的溶解损失 4.0×10-3 Pt等惰性电极、熔融的LiCl LiAlH4+4H2O=LiOH+Al(OH)3+4H2↑ ![]() %
%
【解析】
矿粉加硫酸溶解,发生反应2LiAlSi2O6+4H2SO4=Li2SO4+Al2(SO4)3+4H2SiO3↓、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,过滤后得到滤液1,则滤液1中主要成分为硫酸铝、硫酸铁和硫酸锂;向滤液1中加入碳酸钠调节溶液pH,使硫酸铝、硫酸铁以氢氧化铁和氢氧化铝的沉淀形式析出,过滤后得到滤液2,滤液2的主要成分为硫酸锂,加入碳酸钠后反应得到碳酸锂沉淀,碳酸锂经反应生成LiCl,用惰性电极电解熔融的LiCl,得到单质Li,单质Li再经反应得到四氢铝锂,据此分析解答。
(1)LiAlSi2O6与硫酸反应生成硫酸锂、硫酸铝和不溶于水的硅酸,化学方程式为2LiAlSi2O6+4H2SO4=Li2SO4+Al2(SO4)3+4H2SiO3↓;滤液1中加碳酸钠调节pH结合流程图可知,目的是为了让铁、铝元素以氢氧化铁和氢氧化铝形式除去,故滤渣2的主要成分为Fe(OH)3、Al(OH)3,为了尽量除去杂质,结合表格数据,应将pH调至6.5,使Fe(OH)3、Al(OH)3完全沉淀。
(2)结合表格信息可知,Li2CO3微溶于水且溶解度随温度升高而降低,蒸发浓缩后趁热过滤,能减少Li2CO3的溶解损失;Ksp(Li2CO3)=c2(Li+)c(CO32-)=0.202![]() 0.10=4.0×10-3。
0.10=4.0×10-3。
(3)流程中由LiC1制备金属Li,锂离子在阴极得电子生成金属锂,为防止其他氧离子得电子,电解条件是Pt等惰性电极、熔融的LiCl。
(4)①LiAlH4与水反应生成氢氧化锂、氢氧化铝和氢气,化学方程式为LiAlH4+4H2O=LiOH+Al(OH)3+4H2↑。
②根据反应方程式可知n(H2)=4n(LiAlH4),标况下生成氢气的物质的量n(H2)= ![]() ,则n(LiAlH4)=
,则n(LiAlH4)= ![]() ,m(LiAlH4)=
,m(LiAlH4)= ![]() ,纯度为
,纯度为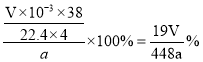

 中考解读考点精练系列答案
中考解读考点精练系列答案