题目内容
【题目】通常情况下,pH<7 的溶液显酸性,pH=7 的溶液显中性,pH>7 的溶液显碱性。以 FeCl3 溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:
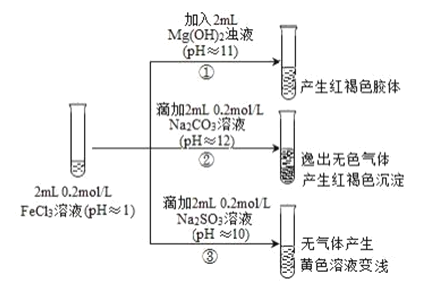
已知:含 Fe2+的溶液中加入 K3Fe(CN)6 溶液生成蓝色沉淀。K3Fe(CN)6 = 3K++Fe(CN)6 3-
(1)①中反应的离子方程式是______。
(2)写出②中发生反应的化学方程式______。
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加 BaCl2 溶液,产生白色沉淀。得出结论:FeCl3 与 Na2SO3 发生了氧化还原反应,其中SO32-被氧化生成了______(填离子的化学式)。
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是取③中反应后的溶液,加入 K3Fe(CN)6 溶液,生成______(填蓝色沉淀的化学式,沉淀中不含钾元素),说明生成了 Fe2+。请写出 FeCl3 与 Na2SO3 溶液反应的离子方程式:______。
【答案】3Mg(OH)2+2Fe3+=2Fe(OH)3(胶体)+3Mg2+ 2FeCl3+3Na2CO3+3H2O=2Fe(OH)3↓+6NaCl+3CO2↑ SO42- Fe3[Fe(CN)6]2 2Fe3++ SO32-+ H2O= 2Fe2++ SO42-+2H+
【解析】
(1) 实验①中反应为氯化铁溶液和Mg(OH)2浊液反应生成红褐色的Fe(OH)3胶体,其离子方程式为::3Mg(OH)2+2Fe3+=2Fe(OH)3(胶体)+3Mg2+,
故答案为:3Mg(OH)2+2Fe3+=2Fe(OH)3(胶体)+3Mg2+;
(2) 实验②为pH=1的FeCl3溶液显酸性, pH=12的Na2CO3溶液显碱性,二者等物质的量混合后,三价铁离子与碳酸根离子都会发生水解,且二者相互促进水解,生成氢氧化铁沉淀和二氧化碳,其反应离子方程式为:2FeCl3+3Na2CO3+3H2O=2Fe(OH)3↓+6NaCl+3CO2↑,
故答案为:2FeCl3+3Na2CO3+3H2O=2 Fe(OH)3↓+6NaCl+3CO2↑;
(3)甲组:由实验现象滴入稀盐酸酸化,再滴加 BaCl2 溶液,产生白色沉淀可知,溶液中经过反应产生SO42-,则Fe3+被还原为Fe2+,化合价降低,故SO32-被Fe3+氧化为SO42-,其离子反应方程式为:2Fe3++ SO32-+ H2O= 2Fe2++ SO42-+2H+,
答案为:SO42-;
乙组:因SO32-可能被空气氧化,若要证实SO32-与Fe3+发生氧化还原反应,可通过验证是否有Fe2+生成,根据题干信息可知,可选用K3Fe(CN)6溶液进行检验,故实验方案为:取③中反应后的溶液,加入K3Fe(CN)6溶液,发生反应生成蓝色沉淀,说明生成了Fe2+,发生的离子反应方程式为3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;根据甲组实验分析,FeCl3 与 Na2SO3 溶液反应的离子方程式. 2Fe3++SO32-+H2O=2Fe2++SO42-+2H+
答案为:Fe3[Fe(CN)6]2;2Fe3++SO32-+H2O=2Fe2++SO42-+2H+。