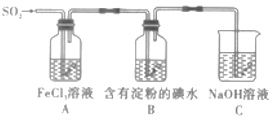
题目内容
【题目】已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75% ,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为无色液体。反应生成的水均已略去。它们有如下图所示的关系。
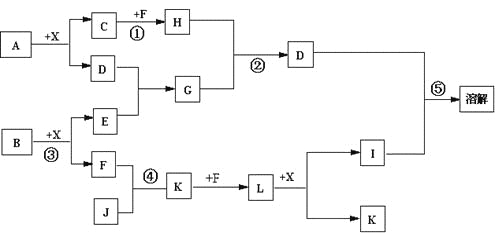
(1)写出化学式:A___________B____________J_____________。
(2)反应③中每生成1molF,转移电子的数目为:___________。
(3)反应④的化学方程式为:________________________________________________。
(4)离子方程式分别为:反应②__________________________________________;
⑤__________________________________________________________。
(5)反应①中,每1.00gC与足量的F作用,恢复到25℃放出55.6kJ热量,写出反应①的热化学方程式__________________________________________________________。
【答案】Al4C3 Na2O2 NH3 2NA(1.204×1024) 4NH3+5O2 ![]() 4NO +6H2O 2AlO2-+ CO2+3H2O ="2" Al(OH)3+CO32-(或AlO2-+ CO2+2H2O = Al(OH)3+HCO3-) Al(OH)3+ 3H+= Al3++ 3H2O CH4(g) + 2O2(g)
4NO +6H2O 2AlO2-+ CO2+3H2O ="2" Al(OH)3+CO32-(或AlO2-+ CO2+2H2O = Al(OH)3+HCO3-) Al(OH)3+ 3H+= Al3++ 3H2O CH4(g) + 2O2(g)![]() CO2(g) +H2O(l);△H=-889.6kJ/mol
CO2(g) +H2O(l);△H=-889.6kJ/mol
【解析】
中学阶段所学知识中淡黄色固体化合物是过氧化钠,所以B是过氧化钠;根据过氧化钠的化学性质,无色液体是水,所以X是水;C是含氢量最高的烃,则C是甲烷;根据B与水反应的产物氢氧化钠与氧气判断,甲烷可与氧气反应,所以F是氧气,E是氢氧化钠;C、J是同周期元素的气态氢化物,猜测J是NH3,所以K是NO,L是NO2,I是HNO3,A是两种元素组成的化合物,由以上分析知A中含有C元素,A与水反应生成甲烷,同时生成的D中应含O元素,即D是氧化物,而氧化物中与氢氧化钠反应的只有Al2O3,所以A中含有C、Al2种元素,A中某种元素的质量分数为75% ,根据元素的常见化合价判断A的化学式是Al4C3,其中Al元素的质量分数是75%。则G是偏铝酸钠,H是二氧化碳,二者反应生成氢氧化铝,氢氧化铝溶于硝酸。
(1)A:Al4C3,B:Na2O2;J:NH3
(2)过氧化钠与水反应每生成1mol氧气,转移电子2mol,其数目为2NA(1.204×1024);
(3)反应④是氨气的催化氧化反应,化学方程式为4NH3+5O2 ![]() 4NO +6H2O
4NO +6H2O
(4)反应②是二氧化碳与偏铝酸钠溶液生成氢氧化铝的反应,离子方程式为
2AlO2-+ CO2+3H2O ="2" Al(OH)3+CO32-;反应⑤是氢氧化铝与硝酸的中和反应,离子方程式为Al(OH)3+ 3H+= Al3++ 3H2O;
(5)甲烷的相对分子质量是16,所以1mol甲烷完全燃烧生成二氧化碳气体和液态水放出的热量是16×55.6kJ=889.6kJ,所以该反应的热化学方程式为CH4(g) + 2O2(g)![]() CO2(g) +H2O(l);△H=-889.6kJ/mol
CO2(g) +H2O(l);△H=-889.6kJ/mol