题目内容
1.化学观念有元素观、微粒观、结构观、转化观、分类观、能量观、守恒观和平衡观等.有关化学观念的说法正确的是( )①分类观:物质及其转化都可以根据某种共性或个性进行分类归纳和研究.
②结构观:物质都有一定的组成结构,结构决定性质.
③平衡观:不能进行到底的反应都可以在一定条件下建立动态平衡;改变某些条件可能打破平衡使之移动,平衡移动是可控的.
④守恒观:所有的化学反应都遵守质量守恒、原子守恒和能量守恒.
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |
分析 ①分类是学习和研究化学的一种常用的基本方法,分类的目的是认清事物的特点,然后分门别类;
②如一氧化碳是由一氧化碳分子构成,二氧化碳是由二氧化碳分子构成,所以一氧化碳和二氧化碳的化学性质不同;
③化学平衡、电离平衡、水解平衡、沉淀溶解平衡,受外界条件影响移动时,都遵循勒夏特列原理;
④所有的化学反应都遵守质量守恒、原子守恒和能量守恒.
解答 解:①根据组成物质的种类将物质分为混合物和纯净物,例如,水是一种纯净物,空气是一种混合物,故①正确;
②结构决定性质,如一氧化碳是由一氧化碳分子构成,二氧化碳是由二氧化碳分子构成,所以一氧化碳和二氧化碳的化学性质不同,故②正确;
③中学化学四大平衡包括化学平衡、电离平衡、水解平衡、沉淀溶解平衡,四大平衡受外界条件影响移动时,都遵循勒夏特列原理,故③正确;
④所有的化学反应都遵守质量守恒、原子守恒和能量守恒,如CO(g)+H2O(g)?CO2(g)+H2(g),故④正确;
故选D.
点评 本题考查化学研究基本方法及作用,明确常见的化学观念是解题的关键,题目难度不大.

练习册系列答案
相关题目
12.有BaCl2和NaCl的混合溶液aL,将它均分成两份.一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀.反应中消耗xmol H2SO4、ymol AgNO3.据此得知原混合溶液中的c(Na+)为( )
| A. | $\frac{y-2x}{a}$ mol/L | B. | $\frac{y-x}{a}$ mol/L | C. | $\frac{2y-2x}{a}$ mol/L | D. | $\frac{2y-4x}{a}$mol/L |
13.与氢硫酸反应有沉淀生成的电解质是( )
| A. | 硫酸铜 | B. | 氢氧化钠 | C. | 硫酸亚铁 | D. | 二氧化硫 |
6.己知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵中,形成无色的溶液.其化学方程 式是PbSO4+2CH3COONH4→(NH4)2SO4+(CH3COO)2Pb.当在醋酸铅溶液中通入硫化氢时,有黑色沉淀硫化铅生成.表示这个反应的离子方程式正确的是( )
| A. | (CH3COO)2Pb+H2S→PbS↓+2CH3COOH | |
| B. | Pb2++2CH3COO-+H2S→PbS↓+2CH3COOH | |
| C. | Pb2++H2S→PbS↓+2H+ | |
| D. | Pb2++2CH3COO-+2H++S2-→PbS↓+2CH3COOH |
13.丹参素能明显抑制血小板的聚集,其结构如图所示,下列说法错误的是( )
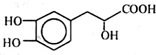

| A. | 丹参素的分子式为C9H10O5 | |
| B. | 1 mol丹参素最多可以和4 mol H2发生加成反应 | |
| C. | 1 mol丹参素在一定条件下与足量金属钠反应可生成2 mol H2 | |
| D. | 丹参素能发生取代、中和、氧化反应等反应 |
10.如表实验方案,不能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验食盐中是否添加KIO3 | 取食盐试样,溶于KI溶液,加入淀淀溶液,观察溶液是否变蓝 |
| B | 验证硝酸是挥发性酸 | 用两根玻璃棒分别蘸取浓硝酸和浓氨水,然后靠近,观察是否有白烟产生 |
| C | 验证Br2氧化性强于Fe3+ | 取少许FeCl2晶体溶于稀盐酸,加入KSCN观察溶液是否变红,滴入溴水后再观察是否变红 |
| D | 检验氯酸钾中含有氯元素 | 取少量氯酸钾加入MnO2充分加热,残留物溶于水,取上层清液,滴入硝酸酸化的AgNO3溶液,观察是否有白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
8.元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T的一种氧化物能使品红溶渡褪色.则下列判断不正确的是( )
| R | X | |
| T | ||
| Z | Q |
| A. | R的单质结构式为: | |
| B. | 工业上以海水为原料,经氧化还原反应制备Q的单质 | |
| C. | 非金属性:Z<T<X | |
| D. | R原子与Z原子的电子数相差26 |
 的物质的量浓度为( )
的物质的量浓度为( ) mol·L-1 B.
mol·L-1 B.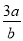 mol·L-1 C.
mol·L-1 C.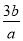 mol·L-1 D.
mol·L-1 D.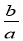 mol·L-1
mol·L-1