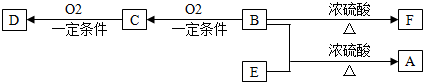
题目内容
将3 mol·L-1的Ca(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO 的物质的量浓度为( )
的物质的量浓度为( )
A. mol·L-1 B.
mol·L-1 B.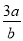 mol·L-1 C.
mol·L-1 C.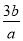 mol·L-1 D.
mol·L-1 D.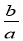 mol·L-1
mol·L-1
练习册系列答案
相关题目
8.将Na、Na2O、NaOH、Na2S、Na2SO4分别加热熔化,需要克服相同类型作用力的物质有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
8.SO2通入足量的Fe(NO3)3稀溶液中,溶液由棕色变为浅绿色,但立即又变成棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀.针对上述一系列变化,下列说法错误的是( )
| A. | 上述过程中,最终被还原的是NO3- | |
| B. | 从上述反应可知氧化性HNO3>Fe3+>稀硫酸 | |
| C. | 上述过程中,会产生一种无色、难溶于水的气体 | |
| D. | 若通入的SO2完全反应,则通入的SO2和逸出的气体物质的量之比为1:1 |


 的物质的量浓度为( )
的物质的量浓度为( )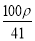 mol·L-1 B.
mol·L-1 B.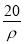 mol·L-1 C.
mol·L-1 C.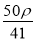 mol·L-1 D.
mol·L-1 D.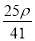 mol·L-1
mol·L-1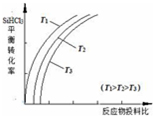 含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石.晶体硅(熔点 1410℃)用途广泛,制取与提纯方法有多种.
含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石.晶体硅(熔点 1410℃)用途广泛,制取与提纯方法有多种.