题目内容
【题目】在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液(含有Fe2+、Fe3+、Cu2+)处理和资源回收很有意义。某兴趣小组设计了如下处理方案。
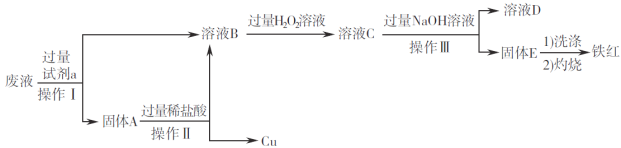
回答下列问题:
(1)固体A的成分是______________(填化学式)。
(2)由溶液B生成溶液C的离子方程式为___________________;检验溶液C中金属阳离子的试剂是____(填名称)。
(3)检验固体E是否洗涤干净的操作为____________________________;灼烧时,用于盛放固体E的仪器为____________________________(填名称)。
(4)铁红用途广泛,可用于焊接钢轨,写出该反应的化学方程式___________________________。
【答案】 Fe、Cu 2Fe2++H2O2+2H+=2Fe3++2H2O 硫氰化钾 取最后一次洗涤液少许于试管中,加硝酸酸化的硝酸银溶液,若无沉淀生成,则洗涤干净;若有沉淀生成,则未洗涤干净 坩埚 2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
【解析】分析:废液中含有Fe2+、Fe3+、Cu2+,废液中加入过量铁屑后发生反应:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu;过滤后得到的沉淀A为Fe、Cu;滤液中含有Fe2+,滤液中加入过量的H2O2,Fe2+被氧化为Fe3+;沉淀A与过量盐酸反应,Fe与盐酸反应生成氯化亚铁,而铜不反应,溶液C与过量NaOH溶液反应生成Fe(OH)3沉淀,E为Fe(OH)3,据此进行解答。
详解: 废液中含有Fe2+、Fe3+、Cu2+,废液中加入过量铁屑后发生反应:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu;过滤后得到的沉淀A为Fe、Cu;滤液中含有Fe2+,滤液中加入过量的H2O2,Fe2+被氧化为Fe3+;沉淀A与过量盐酸反应,Fe与盐酸反应生成氯化亚铁,而铜不反应,
(1)根据分析可以知道,沉淀A含有的单质为Fe、Cu,
因此,本题正确答案是:Fe、Cu;
(2) 溶液B中亚铁离子与H2O2反应生成铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,检验溶液Fe3+的试剂是硫氰化钾
因此,本题正确答案是:2Fe2++H2O2+2H+=2Fe3++2H2O;硫氰化钾;
(3)根据反应过程分析,若Fe(OH)3沉淀没有洗涤干净,表面会含有Cl-,所以检验Fe(OH)3沉淀是否洗涤干净的操作为:取最后一次洗涤液少许于试管中,加硝酸酸化的硝酸银溶液,若无沉淀生成,则洗涤干净;若有沉淀生成,则未洗涤干净;
灼烧氢氧化铁要用坩埚;
因此,本题正确答案是:取最后一次洗涤液少许于试管中,加硝酸酸化的硝酸银溶液,若无沉淀生成,则洗涤干净;若有沉淀生成,则未洗涤干净;坩埚;
(4)铁红发生铝热反应焊接铁轨,反应的化学方程式为:2Al+Fe2O3![]() 2Fe+Al2O3,
2Fe+Al2O3,
因此,本题正确答案是:2Al+Fe2O3![]() 2Fe+Al2O3。
2Fe+Al2O3。

【题目】某化学兴趣小组要完成中和热的测定.回答下列问题:
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5molL﹣1盐酸、0.55molL﹣1NaOH溶液,实验尚缺少的玻璃用品是 .
(2)已知:反应后溶液的比热容c为4.18J℃﹣1g﹣1 , 0.5molL﹣1盐酸和0.55molL﹣1NaOH溶液的密度均为1gcm﹣3 . 实验时记录的实验数据如表:
实验 | 反应物及用量 | 溶 液 温 度 | ||
t1 | t2 | |||
1 | 50mL0.55molL﹣1NaOH溶液 | 50mL.0.5molL﹣1HCl溶液 | 20℃ | 23.3℃ |
2 | 50mL0.55molL﹣1NaOH溶液 | 50mL.0.5molL﹣1HCl溶液 | 20℃ | 23.5℃ |
①盐酸和氢氧化钠反应的中和热△H1=(保留两位小数)
②已知:CH3COOH(aq)CH3COO﹣(aq)+H+(aq)△H2>0,
CH3COOH(aq)+OH﹣(aq)=CH3COO﹣(aq)+H20(l)△H3 则△H3△H1(填“>”、“<”、“=”)