题目内容
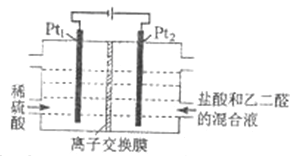
【题目】石油产品中除含有H2S外,还含有各种形态的有机硫,如COS、CH3SH等。
回答下列问题:
(1)CH3SH(甲硫醇)的电子式为__________。
(2)CO和H2S反应可产生羰基硫( COS)。在一恒容密闭容器中发生反应:CO(g)+H2S(g)![]() COS(g)+H2(g)并达到平衡,数据如下表所示:
COS(g)+H2(g)并达到平衡,数据如下表所示:
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
①该反应是________反应(填“吸热”或“放热”)。
②实验1达平衡时,CO的转化率为_______。
③实验2达到平衡时,a_______7.0(填“大于”“小于”或“等于”)。
④实验3达平衡后,再充入1.0 molH2,平衡常数值____(填“增大”“减小”或“不变”)。
(3)COS是大气污染物。在酸性溶液中可用H2O2氧化COS生成一种强酸脱硫。该脱除反应的化学方程式为_______________。
(4)有一种脱硫工艺为:真空K2CO3一克劳斯法。
①K2CO3溶液吸收H2S的反应为K2CO3 +H2S =KHS +KHCO3,该反应的平衡常数的对数值为lgK=_____(已知:H2CO3 lgK1=-6.4,lgK,2=- 10.3;H2S lgKl=-7.0,lgK
②已知下列热化学方程式:
a. 2H2S(g)+3O2(g)=2SO2(g)+2H2O(1) △H1=-1172kJ/mol
b. 2H2S(g)+O2(g)=2S(s)+2H2O(1) △H2 = 632 kJ/mol
克劳斯法回收硫的反应为SO2和H2S气体反应生成S(s),则该反应的热化学方程式为_________。
【答案】  放热 30% 小于 不变 COS + 4H2O2 = CO2 + H2SO4+ 3H2O 3. 3 2H2S (g) +SO2 (g) =3S (s) +2H2O (1) △H=-362kJ/mol
放热 30% 小于 不变 COS + 4H2O2 = CO2 + H2SO4+ 3H2O 3. 3 2H2S (g) +SO2 (g) =3S (s) +2H2O (1) △H=-362kJ/mol
【解析】(1)CH3SH (甲硫醇)是共价化合物,硫原子形成两个共价键,碳原子形成四个共价键,电子式为;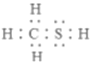 ,故答案为:
,故答案为: ;
;
(2)①实验1和实验3,如果温度不变,平衡时实验的n(CO)=7.0×2=14mol,而现在是16mol,说明升高温度平衡逆向移动,逆反应是吸热,正反应是放热,故答案为:放热;
②CO的转化率为![]() ×100%=30%,故答案为:30%;
×100%=30%,故答案为:30%;
③150℃,K=![]() =
=![]() ,而Qc=
,而Qc=![]() =
=![]() ,即Qc<K,反应向正反应方向移动,所以实验2达平衡时,a<7.0,故答案为:小于;
,即Qc<K,反应向正反应方向移动,所以实验2达平衡时,a<7.0,故答案为:小于;
④K是温度的函数,温度不变K不变,而充入1.0 mol H2,所以K值不变,故答案为:不变;
(3)在酸性溶液中,H2O2氧化COS生成一种强酸为硫酸,反应的化学方程式为COS + 4H2O2 = CO2 + H2SO4+ 3H2O,故答案为:COS + 4H2O2 = CO2 + H2SO4+ 3H2O;
(4)①K2CO3溶液吸收H2S的反应为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数K=![]() =
=![]() ,lgK=LgKa1(H2S)-lgKa2(H2CO3)=-7-(-10.3)=3.3,故答案为:3.3;
,lgK=LgKa1(H2S)-lgKa2(H2CO3)=-7-(-10.3)=3.3,故答案为:3.3;
②a.2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H1=-1172kJ/mol,b.2H2S(g)+O2(g)═2S(s)+2H2O(l) △H2=-632 kJ/mol,盖斯定律计算(b×3-a)×![]() 得到克劳斯法回收硫的反应为SO2和H2S气体反应生成S(s)反应的热化学方程式:2H2S(g)+SO2(g)=3S(s)+2H2O(l)△H=-362 kJmol-1,故答案为:2H2S(g)+SO2(g)=3S(s)+2H2O(l)△H=-362kJmol-1。
得到克劳斯法回收硫的反应为SO2和H2S气体反应生成S(s)反应的热化学方程式:2H2S(g)+SO2(g)=3S(s)+2H2O(l)△H=-362 kJmol-1,故答案为:2H2S(g)+SO2(g)=3S(s)+2H2O(l)△H=-362kJmol-1。

【题目】某化学兴趣小组要完成中和热的测定.回答下列问题:
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5molL﹣1盐酸、0.55molL﹣1NaOH溶液,实验尚缺少的玻璃用品是 .
(2)已知:反应后溶液的比热容c为4.18J℃﹣1g﹣1 , 0.5molL﹣1盐酸和0.55molL﹣1NaOH溶液的密度均为1gcm﹣3 . 实验时记录的实验数据如表:
实验 | 反应物及用量 | 溶 液 温 度 | ||
t1 | t2 | |||
1 | 50mL0.55molL﹣1NaOH溶液 | 50mL.0.5molL﹣1HCl溶液 | 20℃ | 23.3℃ |
2 | 50mL0.55molL﹣1NaOH溶液 | 50mL.0.5molL﹣1HCl溶液 | 20℃ | 23.5℃ |
①盐酸和氢氧化钠反应的中和热△H1=(保留两位小数)
②已知:CH3COOH(aq)CH3COO﹣(aq)+H+(aq)△H2>0,
CH3COOH(aq)+OH﹣(aq)=CH3COO﹣(aq)+H20(l)△H3 则△H3△H1(填“>”、“<”、“=”)