题目内容
【题目】五种短周期元素的部分性质数据如下:
元素 | T | X | Y | Z | W |
原子半径(mm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
最高或最低化合价 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
(1)Z离子的结构示意图为_______________。
(2)关于Y、Z两种元素,下列叙述正确的是__________(填序号)。
a 简单离子的半径Y>Z
b 气态氢化物的稳定性Y比Z强
c 最高价氧化物对应水化物的酸性Z比Y强
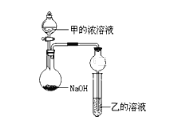
(3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物。某同学设计了如图所示装置(夹持仪器省略)进行实验,将甲的浓溶液逐滴加入到NaOH固体中,烧瓶中即有甲放出,原因是____________________________。一段时间后,观察到试管中的现象是_________________________,发生反应的离子方程式是___________________________。
(4)XO2是导致光化学烟雾的“罪魁祸首”之一。它被氢氧化钠溶液吸收的化学方程式是: 2XO2+2NaOH=M+NaXO3+H2O (已配平),产物M中元素X的化合价为__________。
【答案】![]() b NH3+H2O
b NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小 有白色沉淀生成 Al3++3 NH3·H2O ==Al(OH)3↓+3 NH4+ +3
NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小 有白色沉淀生成 Al3++3 NH3·H2O ==Al(OH)3↓+3 NH4+ +3
【解析】
五种短周期元素,Y有+7、-1价,则Y为Cl,Z有+6、-2价,则Z为S元素;X有+5、-3价,处于ⅤA族,原子半径小于Cl,故Y为N元素;W有最高正价+3,处于ⅢA族,原子半径大于Cl,故W为Al;T有最高正价+1,处于ⅠA族,原子半径小于N,故T为H元素,据此答题。
(1)由Z为短周期元素,其化合价为+6、-2,则Z为S元素,其质子数为16,S2-带2个单位的负电荷,则最外层电子数为8,故S2-的结构示意图为![]() ,故答案为:
,故答案为:![]() 。
。
(2)由Y的化合价及Y为短周期元素,则Y为Cl,氯离子半径小于硫离子半径,则a错误;氯比硫元素的非金属性强,则HCl的稳定性强于H2S,则b正确;氯比硫元素的非金属性强,则高氯酸的酸性大于硫酸的酸性,则c错误,故答案为:b。
(3)由表中的化合价及元素都在短周期,T、X两种元素形成的10e-分子,T为H元素,W为Al元素,则甲为氨气,乙为氯化铝,由图可知,烧瓶中发生氨水与氢氧化钠的反应制取氨气,试管中发生氯化铝与氨水的反应生成沉淀,制取氨气的原理为NH3+H2O![]() NH3H2O
NH3H2O![]() NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小,试管中的反应为Al3++3NH3H2O=Al(OH)3↓+3NH4+,故答案为:NH3+H2O
NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小,试管中的反应为Al3++3NH3H2O=Al(OH)3↓+3NH4+,故答案为:NH3+H2O![]() NH3H2O
NH3H2O![]() NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小;有白色沉淀生成;Al3++3NH3H2O=Al(OH)3↓+3NH4+。
NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小;有白色沉淀生成;Al3++3NH3H2O=Al(OH)3↓+3NH4+。
(4)由X的化合价可知X为第ⅤA族元素,XO2是导致光化学烟雾的“罪魁祸首”之一,则X为N元素,再由2XO2+2NaOH=M+NaXO3+H2O可知,NO2中N元素的化合价+4价,NaNO3中N元素的化合价为+5价,由氧化还原反应中得失电子守恒可知M中N的化合价为+3价,故答案为:+3。

 名校课堂系列答案
名校课堂系列答案


