题目内容
【题目】硫单质及其化合物在化工生产、污水处理等领域应用广泛。
(1)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
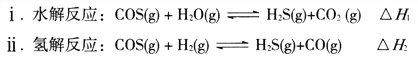
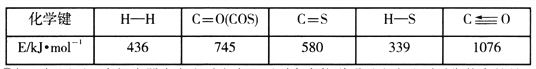
已知反应中相关的化学键键能数据如下表:
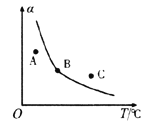
①一定条件下,密闭容器中发生反应i,其中COS(g)的平衡转化率(![]() )与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
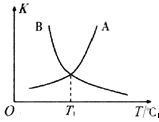
②反应ii的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示逆反应的平衡常数(K逆)的是__________(填“A”或“B”)。T1℃时,向容积为10 L的恒容密闭容器中充入2 mol COS(g)和1 mol H2(g),发生反应ii,COS的平衡转化率为_____________。
(2)过二硫酸是一种强氧化性酸,其结构式为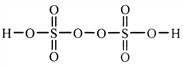
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为________________________。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液的方法制备过二硫酸铵。总反应的离子方程式为________________________________。
(3)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________。②Ksp(HgS)=_____________________。
【答案】 ABC B 33.3% ![]()
![]()
![]()
![]()
【解析】(1). ①跟据化学反应平均速率公式,COS和H2S的化学计量数相同,二者化学反应速率相等,在整个反应中,始终有v(COS)=v(H2S),故 ABC三点全部符合;②反应ii的焓变为:
745+580+436-339*2-1076kJ/mol=7 kJ/mol,正反应为吸热反应,温度升高有利于正反应进行,所以(K逆)为B;T1温度时,正逆反应化学平衡常数相等均为1,设反应达到平衡时转化COS为xmol/L,则容器中各物质的物质的量浓度为:c(COS)=(0.2-x)mol/L,c(H2)=(0.1-x)mol/L,c(H2S)=xmol/L,c(CO)=xmol/L, 由![]() ,可得x=1/15,则COS的平均转化率为:
,可得x=1/15,则COS的平均转化率为:![]() ;
;
(2). ① Ag+作为催化剂,S2O82-、Mn2+与水为反应物,SO42-和MnO4-为生成物,同时生成H+,离子方程式为:![]() ;②由题意得出反应方程式为:H2SO4+(NH4)2SO4
;②由题意得出反应方程式为:H2SO4+(NH4)2SO4![]() (NH4)2S2O8+H2↑,写成离子反应方程式为:2H++2SO42—
(NH4)2S2O8+H2↑,写成离子反应方程式为:2H++2SO42—![]() S2O82-+H2↑;
S2O82-+H2↑;
(3). ①S原子核外电子最外层有6个电子,其与H原子共用一对电子,从Na原子获得一个电子,从而形成稳定结构,电子式为![]() ;反应的平衡常数
;反应的平衡常数![]() ,则
,则![]() 。
。

 口算能手系列答案
口算能手系列答案【题目】Ⅰ、实验室要配制物质的量浓度为0.1 mol/L的NaOH溶液480 mL
(1)填表:
配制时应称量NaOH的质量/g | 已给仪器 | 配制时除已给仪器外还需要的其他仪器 |
__________ | 烧杯、药匙、托盘天平 | ____________________________ |
(2)若要计算该溶液溶质的质量分数,还需要的一个条件是______________(用文字说明)。
(3)下列操作对配制的NaOH溶液浓度有偏高影响的是_________________(填字母)
A.称量NaOH固体时,露置在空气的时间过长
B.选用的容量瓶内有少量的蒸馏水
C.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
D.在定容时仰视容量瓶刻度线
Ⅱ、实验室用下图几个实验装置,可快速制取少量气体,并进行相关性质实验。

(1)若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式:______________________________________。
(2)若A中装有浓盐酸,B中装有固体KMnO4 ,C中盛有KI淀粉溶液,旋开E后,B中出现黄绿色气体。已知1 mol KMnO4发生反应时转移5mol电子。则B中发生反应的离子方程式是:_______;C中的现象是:___________。
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g) ![]() 2NOCl(g)。
2NOCl(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s) ![]() NaNO3(s)+NOCl(g)
NaNO3(s)+NOCl(g)
②4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g)
③2NO(g)+Cl2(g) ![]() 2NOCl(g)
2NOCl(g)
设反应①②③对应的平衡常数依次为K1、K2、K3,则K1、K2、K3之间的关系为____________。
(2)300 ℃时,2NOCl(g) ![]() 2NO(g)+Cl2(g)。正反应速率的表达式为v正=k·cn(NOCl)(k为速率常数,只与温度有关),测得速率与浓度的关系如表所示:
2NO(g)+Cl2(g)。正反应速率的表达式为v正=k·cn(NOCl)(k为速率常数,只与温度有关),测得速率与浓度的关系如表所示:
序号 | c(NOCl)/mol·L-1 | v/mol·L-1·s-1 |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
③ | 0.90 | 3.24×10-8 |
n=________,k=________。
(3)在1 L恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g),在不同温度下测得c(NOCl)与时间t的关系如图A所示:反应开始到10 min时Cl2的平均反应速率v(Cl2)=________ mol·L-1·min-1。
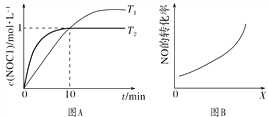
(4)在密闭容器中充入NO(g)和Cl2(g),改变外界条件[温度、压强、![]() 、与催化剂的接触面积],NO的转化率变化关系如图B所示。X代表________。
、与催化剂的接触面积],NO的转化率变化关系如图B所示。X代表________。


