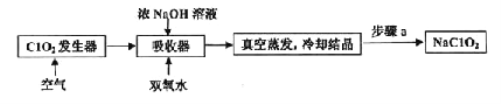
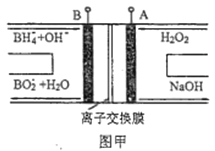
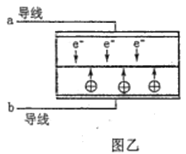
题目内容
【题目】硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为H2SO4==H++HSO4-,HSO4-![]() H++SO42-。请回答下列有关问题:
H++SO42-。请回答下列有关问题:
(1)Na2SO4溶液呈_______(填“弱酸性”“中性”或“弱碱性”),其理由是(用离子方程式表示)_____________。
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为____________________________________。
(3)在:0.10mol/L的Na2SO4溶液中,下列离子浓度关系确的是____(填字母)
A.c(Na+)=c(SO42-)+c(HSO4-)+c(H2SO4)
B.c(OH-)=c(HSO4-)+c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-)
D.c(Na+)=2c(SO42-)+2c(HSO4-)
(4)若25℃时,0.10mol/L的NaHSO4溶液中c(SO42-)=0.029mol/L,则0.10mol/L的H2SO4溶液中c(SO42-)___(填“<”“>”或“=”)0.029mol/L
(5)若25℃时,0.10mol/LH2SO4溶液的pH=-lg0.11,则0.10mol/LH2SO4溶液中c(SO42-)=____mol/L。
【答案】 弱碱性 SO42-+H2O![]() HSO4-+OH- Ba2++HSO4-===BaSO4↓+H+ BCD <(H2SO4溶液中存在:H2SO4===HSO4-+H+,电离出的H+抑制HSO4-的电离) 0.01
HSO4-+OH- Ba2++HSO4-===BaSO4↓+H+ BCD <(H2SO4溶液中存在:H2SO4===HSO4-+H+,电离出的H+抑制HSO4-的电离) 0.01
【解析】
(1)根据硫酸的第一步电离是完全的H2SO4==H++HSO4-,第二步电离是不完全的,HSO4-![]() H++SO42-,可以将SO42-看成弱根离子,Na2SO4溶液中SO42-发生水解:SO42- +H2O
H++SO42-,可以将SO42-看成弱根离子,Na2SO4溶液中SO42-发生水解:SO42- +H2O![]() OH-+ HSO4-
OH-+ HSO4-
所以,溶液呈弱碱性。本题正确答案:(1). 弱碱性 SO42-+H2O![]() HSO4-+OH-
HSO4-+OH-
(2)H2SO4溶液与BaCl2溶液反应离子方程式为. Ba2++HSO4-===BaSO4↓+H+
(3)B为质子守恒;C为电荷守恒;D为物料守恒;所以答案是:BCD
(4)<;H2SO4=HSO4-+H+,电离出的H+抑制HSO4-的电离
(5)0.10 mol·L-1H2SO4溶液的pH=-lg0.11,则c(H+)=0.11mol·L-1,硫酸一级电离出c(H+)为0.1mol·L-1,因此0.11-0.1=0.01,多电离出的H+为二级电离所得,即C(SO42-)=0.01mol·L-1。所以本题答案; 0.01

【题目】O2、O3、N2、N4是氧和氮元素的几种单质。回答下列问题:
(1)O原子中价电子占据的轨道数目为__________________。
(2)第一电离能I1:N____O(填“>”或“<”),第二电离能I2:O大于N的原因是__________________。
(3)O3的空间构型为_________________;是_____________(填“极性”或“非极性”)分子;分子中存在的大π键,可用符号![]() 表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为_______________________。
表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为_______________________。
(4)N元素的简单气态氢化物NH3在H2O中溶解度很大,其原因之一是NH3和H2O可以形成分子间氢键,则在氨水中氢键可以表示为H3N…H-N、___________、____________ (任写两种即可)。
(5)已知:如下键能和键长数目。
化学键 | 键长/pm | 键能/ |
N-N | 145 | 193 |
N=N | 125 | 418 |
N | 110 | 946 |
N2和N4都是N元素的单质,其中N4是正面体构型,N原子占据四面体的四个顶点,从键参数角度分析N4分子稳定性远小于N2原因是________________________________________。
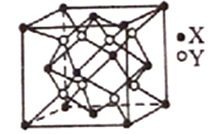
(6)Na2O的晶胞结构如下图所示,X表示O2-,Y表示Na+,则O2-的配位数为_______________,该晶胞的原子空间利用率为_______________;(已知该晶胞的棱长为apm,r(Na+)=xpm,r(O2-)=ypm)。
【题目】铋(Bi)与氮同族,氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色、生产金属铋等。一种以用火法炼铜过程产生的铜转炉烟尘(除含铋的化合物之外,还有CuSO4、ZnSO4、CuS、Fe2O3、PbSO4及As2O3)制备高纯氯氧化铋的工艺流程如下:

请回答:
(1)BiOCl中Bi元素的化合价为__________。
(2)向“酸浸”所得“浸液1”中加入Zn粉,主要目的是__________________________。
(3)“浸铜”时,有单质硫生成,其反应的离子方程式为____________________________。
(4)“浸铋”时,温度升高,铋的浸出率降低,其原因为____________________________。
(5)“沉铋”时需控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为__________。
(6)“除铅、砷”时,可以采用以下两种方法:
①加入改性羟基磷灰石固体(HAP):浸液2与HAP的液固比(L/S)与铅、砷去除率以及后续沉铋量的关系如下表:
L/S | 125∶1 | 50∶1 | 25∶1 | 15∶1 |
Pb2+去除率/% | 84.86 | 94.15 | 95.40 | 96.83 |
As3+去除率/% | 98.79 | 98.92 | 98.34 | 99.05 |
m(沉铋)/g | 2.34 | 2.33 | 2.05 | 1.98 |
实验中应采用的L/S=__________。
②铁盐氧化法:向浸液2中加入Fe2(SO4)3,并调节pH,生成FeAsO4沉淀。当溶液中c(AsO43-)=1×10-9mol/L,且不产生Fe(OH)3沉淀,此时溶液的pH为__________。(已知:1g2=0.3;FeAsO4、Fe(OH)3的Ksp分别为5×10-21、4×10-38。)