题目内容
【题目】钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。用含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如下:
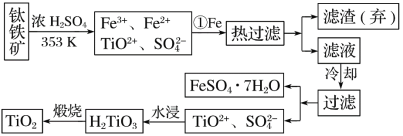
(1)步骤①加Fe的目的是________________________________________________________;步骤②冷却的目的是________________________________________________________。
(2)上述制备TiO2的过程中,可以利用的副产物是______________________。
(3)由金红石(TiO2)制取单质Ti,涉及到的步骤为TiO2―→TiCl4![]() Ti,反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由是_________________________。
Ti,反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由是_________________________。
【答案】将Fe3+还原为Fe2+ 析出(或分离、或得到)FeSO4·7H2O FeSO4·7H2O 防止高温下Mg(Ti)与空气中的O2(或CO2、N2)反应
【解析】
(1)铁粉的作用由步骤①的前后以及最后所得产物中的FeSO47H2O分析,不难得出是为了除去混合溶液中的Fe3+;
(2)步骤②冷却的目的由操作过滤和得到的物质是FeSO47H2O可得,是为降低FeSO47H2O的溶解度;
(3)Mg是活泼金属,能与空气中多种物质反应,因此可得出Ar气作用为保护气,防止Mg和空气中物质反应。
(1)由框图所示流程分析可知,要将TiO2+与Fe3+、Fe2+分离,需要先加入铁粉将Fe3+还原为Fe2+,趁热过滤除去残渣,再将滤液冷却使FeSO4·7H2O析出,步骤②冷却的目的由操作过滤和得到的物质是FeSO47H2O可得,是为降低FeSO47H2O的溶解度,故答案为:
将Fe3+还原为Fe2+,析出(或分离、或得到)FeSO4·7H2O。
(2)得到的副产物为FeSO47H2O,故答案为:FeSO4·7H2O。
(3)Mg是活泼金属,能与空气中多种物质反应,因此可得出Ar气作用为保护气,防止Mg和空气中物质反应,故答案为:防止高温下Mg(Ti)与空气中的O2(或CO2、N2)反应。

 阅读快车系列答案
阅读快车系列答案【题目】铋(Bi)与氮同族,氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色、生产金属铋等。一种以用火法炼铜过程产生的铜转炉烟尘(除含铋的化合物之外,还有CuSO4、ZnSO4、CuS、Fe2O3、PbSO4及As2O3)制备高纯氯氧化铋的工艺流程如下:

请回答:
(1)BiOCl中Bi元素的化合价为__________。
(2)向“酸浸”所得“浸液1”中加入Zn粉,主要目的是__________________________。
(3)“浸铜”时,有单质硫生成,其反应的离子方程式为____________________________。
(4)“浸铋”时,温度升高,铋的浸出率降低,其原因为____________________________。
(5)“沉铋”时需控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为__________。
(6)“除铅、砷”时,可以采用以下两种方法:
①加入改性羟基磷灰石固体(HAP):浸液2与HAP的液固比(L/S)与铅、砷去除率以及后续沉铋量的关系如下表:
L/S | 125∶1 | 50∶1 | 25∶1 | 15∶1 |
Pb2+去除率/% | 84.86 | 94.15 | 95.40 | 96.83 |
As3+去除率/% | 98.79 | 98.92 | 98.34 | 99.05 |
m(沉铋)/g | 2.34 | 2.33 | 2.05 | 1.98 |
实验中应采用的L/S=__________。
②铁盐氧化法:向浸液2中加入Fe2(SO4)3,并调节pH,生成FeAsO4沉淀。当溶液中c(AsO43-)=1×10-9mol/L,且不产生Fe(OH)3沉淀,此时溶液的pH为__________。(已知:1g2=0.3;FeAsO4、Fe(OH)3的Ksp分别为5×10-21、4×10-38。)