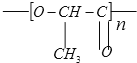题目内容
【题目】写出下列有机物所表示的物质的分子式。
(1)![]() ___________________;
___________________;
(2)![]() ___________________;
___________________;
(3)![]() ___________ ;
___________ ;
(4)![]() __________________
__________________
【答案】(1)C8H18(2)C6H12(3)C4H8Br2 (4)C9H8O2
【解析】试题分析:(1)键线式中每个折点和线端点处表示有一个碳原子,并以氢原子补足四键,故此有机物中含8个碳原子,18个氢原子,故分子式为C8H18,故答案为:C8H18;
(2)键线式中每个折点和线端点处表示有一个碳原子,并以氢原子补足四键,故此有机物中含6个碳原子,12个氢原子,故分子式为C6H12,故答案为:C6H12;
(3)键线式中每个折点和线端点处表示有一个碳原子,并以氢原子补足四键,故此有机物中含5个碳原子,10个氢原子,2个Br原子,故分子式为C5H10Br2,故答案为:C5H10Br2;
(4)键线式中每个折点和线端点处表示有一个碳原子,并以氢原子补足四键,故此有机物中含9个碳原子,8个氢原子,2个O原子,故分子式为C9H8O2,故答案为:C9H8O2。

【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
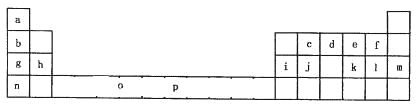
试回答下列问题:
(1)元素p为26号元素,请画出其基态原子外围电子排布图______________;
(2)e与a反应的产物的分子中中心原子的杂化形式为________________;该分子是_________(填“极性”或“非极性”)分子。
(3)上表中元素基态原子的第一电离最大的元素是__________。(用元素符号表示)
(4)o、p两元素的部分电离能数据列于下表:
元 素 | O | P | |
电离能 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难,对此,你的解释是______________;
【题目】【2016届邯郸一模】【化学选修3:物质结构与性质】
新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高能层符号为_________,该能层具有的原子轨道数为________。
②LiBH4由Li+和BH4-构成,BH4-的立体结构是_________,B原子的杂化轨道类型是________。
Li、B、H元素的电负性由大到小排列顺序为________。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径Li+_______H-(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 | I4/kJmol-1 | I5/kJmol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是________ (填元素符号)。
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H-的半径为________,NaH的理论密度是___________g·cm-3(只列算式,不必计算出数值,阿伏加德罗常数为NA)