题目内容
【题目】某新型药物H(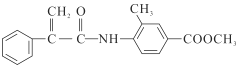 )是一种可用于治疗肿瘤的药物,其合成路线如图所示:
)是一种可用于治疗肿瘤的药物,其合成路线如图所示:

已知:
(1)E的分子式为C9H8O2,能使溴的四氯化碳溶液褪色;
(2)RCOOH![]()
![]() ;
;
(3)![]() +R1NH2
+R1NH2![]()
![]() +HBr。(以上R,R1均为烃基)
+HBr。(以上R,R1均为烃基)
请回答下列问题:
(1)A的结构简式为___________;E的官能团的名称为___________。
(2)①的反应类型是________;④的反应条件是__________。
(3)写出C→D的化学方程式:______________________。
(4)写出F+G→H的化学方程式:_________________________________________。
(5)E有多种同分异构体,同时满足下列条件的E的同分异构体有____(考虑顺反异构)种。
i.能发生银镜反应;
ii.能发生水解反应;
iii.分子中含的环只有苯环。
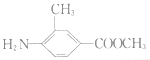
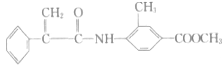
(6)参照H的上述合成路线,设计一条由乙醛和NH2CH(CH3)2为起始原料制备医药中间体CH3CONHCH(CH3)2的合成路线__________________________________。
【答案】 碳碳双键、羧基 加成反应 浓硫酸、加热
碳碳双键、羧基 加成反应 浓硫酸、加热 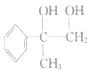 +O2
+O2![]() +H2O
+H2O 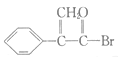 +
+ 
![]()
 +HBr 5
+HBr 5 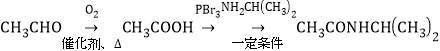
【解析】
根据流程分析,A为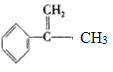 ,C为
,C为 ,D为
,D为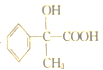 ,E为
,E为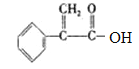 ,F为
,F为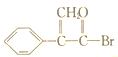 ,G为
,G为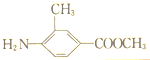 ,H为
,H为
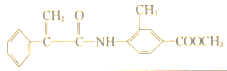 。
。
(1)根据A到B的转化关系,由B逆推出A为 ,E为
,E为  ,E中官能团为碳碳双键、羧基 故答案为:
,E中官能团为碳碳双键、羧基 故答案为: ;碳碳双键、羧基。
;碳碳双键、羧基。
(2)由流程可知,A到B的反应发生在碳碳双键上,故①为加成反应,D为 ,E为
,E为 , D到E发生的是消去反应,反应条件是浓硫酸、加热,故答案为:加成反应;浓硫酸,加热。
, D到E发生的是消去反应,反应条件是浓硫酸、加热,故答案为:加成反应;浓硫酸,加热。
(3)C→D的化学方程式: +O2
+O2![]()
 +H2O ,故答案为:
+H2O ,故答案为:
 。
。
(4)F+G→H的化学方程式: +
+
![]()

![]() HBr,故答案为:
HBr,故答案为:
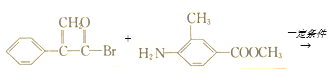
 +HBr。
+HBr。
(5)E的分子式为C9H8O2,E的同分异构体满足i.能发生银镜反应; ii.能发生水解反应;说明含有甲酸形成的酯基,iii.分子中含的环只有苯环,说明苯环侧链含有碳碳双键,只有一个取代基为HCOO-CH=CH-或![]() ;有2个取代基为-CH=CH2和-OOCH,有邻,间,对三种,故符合条件的有5种,故答案为:5。
;有2个取代基为-CH=CH2和-OOCH,有邻,间,对三种,故符合条件的有5种,故答案为:5。
(6)参照H的上述合成路线,由乙醛和NH2CH(CH3)2为起始原料制备医药中间体CH3CONHCH(CH3)2的合成路线为:
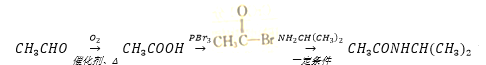 ,故答案为:
,故答案为:
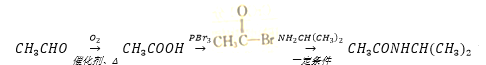 。
。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】锰及其化合物在工农业生产和科技领域具有广泛的应用。
Ⅰ.溶液中的Mn2+可被酸性(NH4)2S2O8溶液氧化为MnO4-,该方法可用于检验Mn2+。
(1)用酸性(NH4)2S2O8溶液检验Mn2+时的实验现象为________________________。
(2)该反应的离子方程式为_____________________。
(3)(NH4)2S2O8可视为由两分子琉酸缩合所得,若硫酸的结构简式为 ,则H2S2O8的结构简式为 ________________。
,则H2S2O8的结构简式为 ________________。
Ⅱ.实验室用含锰废料(主要成分为MnO2,还含有少量Al2O3、MgO、SiO2)为原料制备Mn的工艺流程如下图所示。

已知:①部分难溶物的溶度积常数如下表所示。
难溶物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
溶度积常数 | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
②当溶液中离子浓度≤1.0×10-5mol L-1时,可认为该离子沉淀完全。
(1)“酸浸”时,MnO2将Fe氧化为Fe3+,该反应的离子方程式为________________________;该过程中浸出时间和液固比对锰浸出率的影响分别如下图所示。

则适宜的浸出时间和液固比分别为____________、____________。
(2)若“酸浸”后所得滤液中c(Mn2+)=0.18molL-1,则应“调pH”的范围为________________________。
(3)“煅烧”反应中氧化剂与还原剂的物质的量之比为__________。“还原”时发生的置换反应在化学上又叫作__________。
【题目】一定温度下,在密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如表所示,下列说法不正确的是
物质 | X | Y | Z | W |
初始浓度/mol·L-1 | 0.5 | 0.5 | 0 | 0 |
平衡浓度/mol·L-1 | 0.1 | 0.1 | 0.4 | 0.4 |
A. 反应达到平衡时,X的体积分数为10%
B. 该温度下反应的平衡常数K=16
C. 保持温度不变增大压强,反应速率加快,平衡向正反应方向移动
D. 若X、Y的初始浓度均为0.8 mol·L-1,则达到平衡时,W的浓度为0.64 mol·L-1