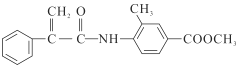
题目内容
【题目】在一定条件下,可逆反应A(g) + B(g) ![]() mC(g)变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,下列说法正确的是( )
mC(g)变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,下列说法正确的是( )

A. T1 < T2
B. 正反应是放热反应
C. m<2
D. 恒温、恒容充入稀有气体,平衡逆向移动
【答案】B
【解析】
根据平衡移动原理分析判断。
A项:其它条件相同时,T1温度下先达到平衡,则反应快、温度高,T1 > T2 ,A项错误;
B项:较高温度T1平衡时C%较小,较低温度T2平衡时C%较大,即升温左移,逆反应吸热、正反应放热,B项正确;
C项:T2温度平衡后加压,C%减小,即加压左移,m>2,C项错误;
D项:恒温、恒容充入稀有气体,不能改变正、逆反应速率,化学平衡不移动,D项错误。
本题选B。

【题目】自然界井不缺少“镁”,缺少的是发现“镁”的眼晴。海水中镁的绝对含量高但相对浓度却小[c(Mg2+)约为0.054mo1L﹣1]。工业上常从海水中提镁,其生产过程的讨论方案如图所示:

(1)要实现对海水中镁元素的富集,一般采取______(填编号)。①直接往海水中加入沉淀剂;②利用晒盐后的苦卤水,向其中加入沉淀剂;③先加热蒸发海水,再加入沉淀剂
(2)根据表中4种试剂的市场价格数据,选择_____做沉淀剂最合理,如果“提镁”工厂就建在海边,____是生产这种试剂的最好原料。
试剂 | NaOH | KOH | Ca(OH)2 | Ba(OH)2 |
价格(元/吨) | 3300 | 9500 | 580 | 3500 |
(3)根据下表中3种电解质的熔点数据,上图方案中,方案______最优,此方案采取电解熔融态电解质而不是电解其水溶液,原因是______;电解的化学方程式为_____。
电解质 | MgCl2 | MgO | MgSO4 |
熔点/℃ | 714 | 2800 | 1327 |
(4)电解所得的镁蒸气冷却后即为固体镁,冷却镁蒸气可以选择_______氛围。
A、N2 B、CO2 C.Ar D.空气
【题目】以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:

(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是_______。
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。

① 溶液a呈酸性,原因是______。
② 根据如图所示的溶解度曲线,将溶液a______(填操作),可得NH4Cl粗品。
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物 | ZnCl2 | NH4Cl |
熔点 | 365℃ | 337.8℃分解 |
沸点 | 732℃ | ------------- |
根据上表,设计方案提纯NH4Cl:________。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入_______(填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:________。
② 解释试剂加入顺序不同,MnO2作用不同的原因:________。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。