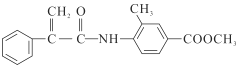
题目内容
【题目】某稀土元素R的精矿样品中,R的氧化物的质量分数为0.8515。10.1g该样品与50mL1mol/L硫酸恰好完全反应(杂质不反应),生成ROSO4和H2O,则R的相对原子质量约为
A. 78B. 140C. 156D. 172
【答案】B
【解析】
依此判断氧化物的化学式和物质的量;R的氧化物的质量分数为0.8515.依此计算出20.2g该样品中氧化物的质量;再根据![]() 进行计算,得出正确结论。
进行计算,得出正确结论。
生成的为ROSO4,则R的化合价为+4价,所以该氧化物的化学式为RO2,
R的氧化物的质量分数为0.8515,则20.2g该样品中RO2的质量为:20.2g×0.8515=17.2003g,
20.2g该样品与100mL1mol/L稀硫酸恰好完全反应(杂质不反应)生成ROSO4和H2O,则20.2g该样品中RO2的物质的量为100mL×1mol/L = 0.1mol,
故RO2的摩尔质量为![]() ≈172g/mol,故R的相对原子质量为:17216×2=140,B项正确,答案选B。
≈172g/mol,故R的相对原子质量为:17216×2=140,B项正确,答案选B。

【题目】自然界井不缺少“镁”,缺少的是发现“镁”的眼晴。海水中镁的绝对含量高但相对浓度却小[c(Mg2+)约为0.054mo1L﹣1]。工业上常从海水中提镁,其生产过程的讨论方案如图所示:

(1)要实现对海水中镁元素的富集,一般采取______(填编号)。①直接往海水中加入沉淀剂;②利用晒盐后的苦卤水,向其中加入沉淀剂;③先加热蒸发海水,再加入沉淀剂
(2)根据表中4种试剂的市场价格数据,选择_____做沉淀剂最合理,如果“提镁”工厂就建在海边,____是生产这种试剂的最好原料。
试剂 | NaOH | KOH | Ca(OH)2 | Ba(OH)2 |
价格(元/吨) | 3300 | 9500 | 580 | 3500 |
(3)根据下表中3种电解质的熔点数据,上图方案中,方案______最优,此方案采取电解熔融态电解质而不是电解其水溶液,原因是______;电解的化学方程式为_____。
电解质 | MgCl2 | MgO | MgSO4 |
熔点/℃ | 714 | 2800 | 1327 |
(4)电解所得的镁蒸气冷却后即为固体镁,冷却镁蒸气可以选择_______氛围。
A、N2 B、CO2 C.Ar D.空气