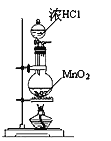
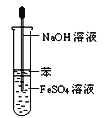
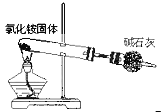
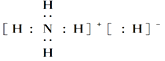题目内容
【题目】下列实验方法不能达到实验目的的是
A.可用丁达尔效应来区分溶液和胶体
B.用NaOH溶液除去CO2中混有的少量HCl
C.可用热分解的方法提纯混有少量CaCO3的CaO
D.向AlCl3溶液中滴加过量氨水可制得Al(OH)3
【答案】B
【解析】
A、胶体能产生丁达尔效应,溶液不能产生丁达尔效应,可以区分,选项A正确;
B、CO2和HCl气体均与NaOH溶液反应,不符合除杂原则,选项B错误;
C、碳酸钙高温分解生成CaO,则选择高温分解法除去CaO中的CaCO3,选项C正确;
D、Al(OH)3为两性氢氧化物,易与强碱反应而溶解,但不与弱碱反应,氨水为弱碱,与AlCl3溶液反应生成Al(OH)3,选项D正确;
答案选B。

【题目】为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25℃,1.01×105Pa时,实验测得,4g氢气在O2中完全燃烧生成液态水,放出572kJ的热量,则表示H2的燃烧热的热化学方程式为________________________________。
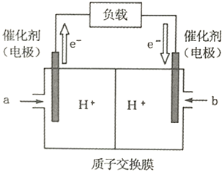
(2)下图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从_________处通入(填“a”或“b”),电池内部H+向_________(填“左”或“右”)移动。写出电池负极的电极反应式_________________________________。
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H-H | N-H | N≡N |
键能/ kJ·mol-1 | 436 | a | 945 |
已知:N2(g)+3H2(g)=2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据计算a的数值__________。
(4)已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(1) △H2=-571.6 kJ·mol-1 ②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(1) △H3=-2599 kJ·mol-1 ③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=_______________。