题目内容
【题目】面对日益加剧的能源危机,我国《能源发展纲要》中倡导大力发展替代能源,如风能、电能等,要大力开发电动自行车、电动摩托车、电动汽车。回答下列问题:
(1)下列物质中可以作为燃料电池的负极反应物的是(____)
A.CH4 B.H2 C.C2H5OH D.CO2
(2)若用CH4作燃料,氢氧化钾溶液作电解质溶液,写出负极上的电极反应式_______________。
(3)电池工作时,溶液中KOH的物质的量浓度________(填“增大”“不变”或“减小”)。
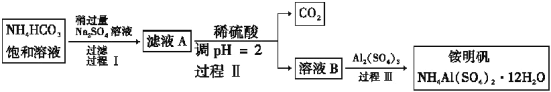
(4)某温度下的饱和Na2SO4溶液的溶解度为25 g,用甲烷燃料电池进行电解,当阳极产生3.36 L(标准状况)气体时,电路中通过电子的物质的量为_______,消耗甲烷的物质的量为_______,此时,析出Na2SO4·10H2O的质量为________。
【答案】A、B、C CH4-8e-+10OH-=CO32-+7H2O 减小 0.6 mol 0.07 5 mol 4.5 g
【解析】
(1)可以作为燃料电池的负极反应物应具有还原性;
(2)电解质是KOH溶液时,二氧化碳和氢氧化钾反应得到的是碳酸钾;
(3)反应消耗KOH,KOH的物质的量减小,浓度减小;
(4)阳极电极反应式为O2+2H2O+4e-=4OH-。
(1)可以作为燃料电池的负极反应物应具有还原性,ABC符合,故答案为:ABC;
(2)甲烷燃料电池以KOH溶液为电解质溶液时,负极上是甲烷发生失电子的氧化反应,又因为电解质是KOH溶液,二氧化碳和氢氧化钾反应得到的是碳酸钾,即负极上的电极反应式为CH4+10OH--8e-=CO32-+7H2O;
(3) 由总反应为CH4+2O2+2KOH=K2CO3+3H2O,电解液中KOH的物质的量减少,则浓度减小;
(4) 甲烷燃料电池总反应为CH4+2O2+2KOH=K2CO3+3H2O,电解池的总反应为:2H2O![]() 2H2↑+O2↑,阳极电极反应式为O2+2H2O+4e-=4OH-。当阳极产生3.36 L(标准状况)气体时,即0.15 mol O2时,电路中通过电子的物质的量为0.15 mol
2H2↑+O2↑,阳极电极反应式为O2+2H2O+4e-=4OH-。当阳极产生3.36 L(标准状况)气体时,即0.15 mol O2时,电路中通过电子的物质的量为0.15 mol ![]() =0.6 mol,消耗甲烷的物质的量为0.15 mol
=0.6 mol,消耗甲烷的物质的量为0.15 mol![]() =0.07 5 mol。电解消耗水为0.15 mol
=0.07 5 mol。电解消耗水为0.15 mol ![]() =5.4 g,设析出Na2SO4·10H2O的质量为X,则有:
=5.4 g,设析出Na2SO4·10H2O的质量为X,则有: =
=![]() ,X=4.5 g。
,X=4.5 g。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案