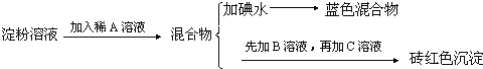
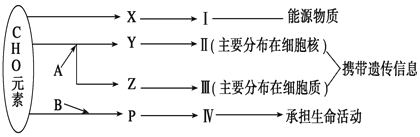
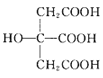
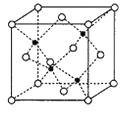
题目内容
【题目】硫单质及其化合物在工农生产中有着重要的应用,请回答下列问题:
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)=CaO(s)+SO2(g)+CO2(g) △H=+210.5kJ·mol-1
②1/4CaSO4(s)+CO(g)=1/4CaS(s)+CO2(g) △H=-47.3kJ·mol-1
反应:CaO(s)+3CO(g)+SO2(g)=CaS(s)+3CO2(g) △H=_____________kJ·mol-1
(2)下图为密闭容器中H2S气体分解生产H2和S2(g)的平衡转化率与温度、压强的关系。
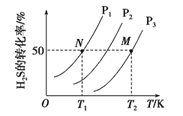
该反应平衡常数的大小关系为K(T1) ____K(T2)(填“>”、“=”或“<”),理由是____。用各物质的平衡分压代替平衡浓度表示反应的平衡常数,记为Kp,计算该反应在T1温度下的Kp=_________(用p1表示)。
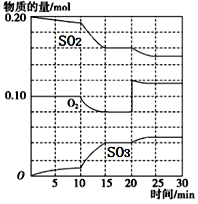
(3)在一定条件下,二氧化硫和氧气发生反应:2SO2(g)+O2(g) ![]() 2SO3 (g)△H<0。据下图判断,反应进行至20min时,曲线发生变化的原因是________________(用文字表达);10min到15min的曲线变化的原因可能是________(填写编号)。
2SO3 (g)△H<0。据下图判断,反应进行至20min时,曲线发生变化的原因是________________(用文字表达);10min到15min的曲线变化的原因可能是________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO2的物质的量
(4)烟气中SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=__________________(用含硫微粒浓度的代数式表示)。
【答案】-399.7 < 在同一压强下,T2温度下H2S的转化率更大,说明升高温度,平衡正向移动,平衡常数增大 0.2p1或1/5p1 增大氧气的浓度(或充入氧气) ab 2c(SO32-)+c(HSO3-)
【解析】
试题本题考查盖斯定律的应用,化学平衡图像的分析,化学平衡常数的计算,外界条件对化学平衡的影响,溶液中粒子浓度的关系。
(1)应用盖斯定律,②![]() 4-①得CaO(s)+3CO(g)+SO2(g)=CaS(s)+3CO2(g)ΔH=(-47.3kJ/mol)
4-①得CaO(s)+3CO(g)+SO2(g)=CaS(s)+3CO2(g)ΔH=(-47.3kJ/mol)![]() 4-(+210.5kJ/mol)=-399.7kJ/mol。
4-(+210.5kJ/mol)=-399.7kJ/mol。
(2)任取一曲线(压强相同),由图像可见升高温度H2S的转化率增大,升高温度平衡向正反应方向移动,化学平衡常数增大,则K(T1)![]() K(T2)。由图可见T1、p1平衡时H2S的转化率为50%,设H2S起始物质的量为a,用三段式
K(T2)。由图可见T1、p1平衡时H2S的转化率为50%,设H2S起始物质的量为a,用三段式
2H2S(g)![]() 2H2(g)+S2(g)
2H2(g)+S2(g)
n(起始)(mol) a 0 0
n(转化)(mol) 0.5a 0.5a 0.25a
n(平衡)(mol) 0.5a 0.5a 0.25a
平衡时H2S、H2、S2(g)总物质的量为1.25a,H2S、H2、S2(g)物质的量分数依次为0.4、0.4、0.2,H2S、H2、S2(g)的平衡分压依次为0.4p1、0.4 p1、0.2 p1,Kp=(0.4 p1)2![]() 0.2 p1
0.2 p1![]() (0.4 p1)2=0.2p1。
(0.4 p1)2=0.2p1。
(3)反应进行到15min达到平衡,反应进行至20min,O2物质的量由0.08mol突然增大到0.12mol,即增大O2的浓度(或充入O2)。10min到15min中反应速率加快,10min瞬间各物质物质的量不变,a,加入催化剂可加快反应速率,a项可能;b,缩小容器体积可加快反应速率,b项可能;c,降低温度减慢反应速率,c项不可能;d,增加SO2物质的量,SO2物质的量应突然增大,d项不可能;答案选ab。
(4)Na2SO3和NaHSO3混合溶液中的电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-),溶液呈中性c(H+)=c(OH-),则c(Na+)=c(HSO3-)+2c(SO32-)。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】实验室中某些气体的制取.收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. AB. BC. CD. D