题目内容
【题目】下列装置或操作不能达到实验目的的是
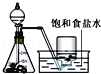
A. 实验室制氯气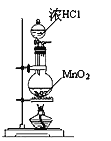 B. 氢氧化亚铁的制取
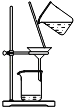
B. 氢氧化亚铁的制取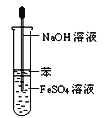 C. 氨气的制取
C. 氨气的制取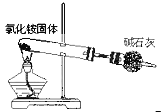 D. 检查装置气密性
D. 检查装置气密性
【答案】C
【解析】
A、二氧化锰将氯离子氧化,制取氯气;
B、用苯作液封、将盛氢氧化钠的胶头滴管插入液面以下,可以达到防氧化的作用;
C、氯化铵分解后在管口又重新化合生成氯化铵固体;
D、长颈漏斗和烧瓶中形成稳定的液面差。
A、二氧化锰将氯离子氧化,加热浓盐酸和二氧化锰的混合物可以制取氯气,故A正确;
B、用苯作液封、将盛氢氧化钠的胶头滴管插入液面以下,都可以达到防止亚铁离子被氧化的作用,故B正确;
C、氯化铵分解后在管口又重新化合生成氯化铵固体,无法收集到氨气,故C错误;
D、长颈漏斗和烧瓶中形成稳定的液面差,说明气密性良好,故D正确。
故选C。

 名校课堂系列答案
名校课堂系列答案【题目】(一)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。

(1)收集到(CH3)4NOH的区域是________(填a、b、c或d)。
(2)写出电池总反应_____________。
(二)乙酸乙酯一般通过乙酸和乙醇酯化合成:CH3COOH(l)+C2H5OH(l) ![]() CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
已知纯物质和相关恒沸混合物的常压沸点如下表:
纯物质 | 沸点/℃ | 恒沸混合物(质量分数) | 沸点/℃ |
乙醇 | 78.3 | 乙酸乙酯(0.92)+水(0.08) | 70.4 |
乙酸 | 117.9 | 乙酸乙酯(0.69)+乙醇(0.31) | 71.8 |
乙酸乙酯 | 77.1 | 乙酸乙酯(0.83)+乙醇(0.08) +水(0.09) | 70.2 |
请完成:
(1)关于该反应,下列说法不合理的是_____________。
A.反应体系中硫酸有催化作用
B.因为化学方程式前后物质的化学计量数之和相等,所以反应的ΔS等于零
C.因为反应的△H 接近于零,所以温度变化对平衡转化率的影响大
D.因为反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计
(2)一定温度下该反应的平衡常数K=4.0。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率y =_________;若乙酸和乙醇的物质的量之比为n : 1,相应平衡体系中乙酸乙酯的物质的量分数为x,请在图中绘制x随n变化的示意图(计算时不计副反应)________。
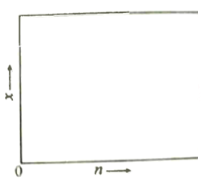
(3)工业上多采用乙酸过量的方法,将合成塔中乙酸、乙醇和硫酸混合液加热至110℃左右发生酯化反应并回流,直到塔顶温度达到70~71℃,开始从塔顶出料。控制乙酸过量的作用有___________________。
(4)近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g) ![]() CH3COOC2H5(g)+2H2(g)
CH3COOC2H5(g)+2H2(g)
在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图所示。关于该方法,下列推测合理的是_____。
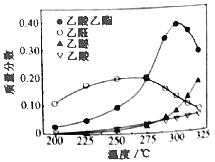
A.反应温度不宜超过300℃
B.增大体系压强,有利于提高乙醇平衡转化率
C.在催化剂作用下,乙醛是反应历程中的中间产物
D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键
【题目】下表是元素周期表的一部分,请回答:
族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)元素⑦的原子结构示意图为_____;元素⑩的名称为______;
(2)在这些元素中,化学性质最活泼的金属元素是____(填元素符号,下同),最不活泼的元素是___;原子半径最小的元素是_____;
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是___(填化学式,下同);具有两性的是____。
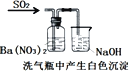
【题目】下列实验对应的结论正确的是
选项 | A | B | C | D |
装置 |
|
|
|
|
结论 | 用浓盐酸与二氧化锰制氯气 | 能证明非金属性 Cl>C>Si | 分离出Cl2与KI溶液反应生成的碘 | 白色沉淀一定是BaSO4 |
A. A B. B C. C D. D