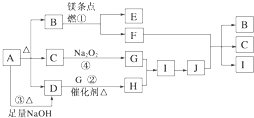
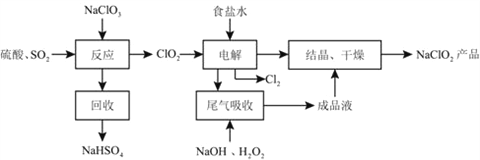
题目内容
【题目】下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
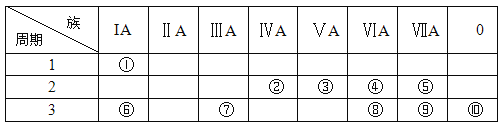
(1)非金属性最强的是___(填元素名称),化学性质最不活泼的是____(填元素符号)。
(2)元素①-⑩中半径最大的元素是____(填元素符号)
(3)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是________。(填化学式)
(4)表中能形成两性氢氧化物的元素是______(填元素符号)
【答案】氟 Ar Na HClO4>HNO3>H2CO3 Al
【解析】
根据元素在周期表的位置,可推出①-⑩元素分别是H、C、N、O、F、Na、Al、S、Cl、Ar,然后根据元素周期律分析判断。
根据上述分析可知①-⑩元素分别是H、C、N、O、F、Na、Al、S、Cl、Ar。
(1)由于同一周期的元素随原子序数的增大,元素的非金属性逐渐增强;同一主族的元素,随原子核外电子层数的增多,元素的非金属性逐渐减弱,所以上述10种元素中非金属性最强的元素是氟元素;惰性气体原子最外层达到8个(He是K层的2个电子)的稳定结构,因此化学性质最不活泼的是⑩号的Ar元素;
(2)由于同一周期的元素随原子序数的增大,元素的原子半径逐渐减小;同一主族的元素,随原子序数的增大而增大,所以元素①-⑩中半径最大的元素是Na元素;
(3)②表示的是C元素;③表示的是N元素;⑨表示的是Cl元素,三种元素的最高价含氧酸分别是H2CO3、HNO3、HClO4,H2CO3是二元弱酸;HNO3是一元强酸;HClO4是所有酸中酸性最强的一种,因此这三种酸的酸性由强到弱的顺序是HClO4>HNO3>H2CO3;
(4)⑦号表示的Al元素处于金属与非金属交界处,其氢氧化物Al(OH)3是两性氢氧化物,可以与强酸、强碱发生反应产生盐和水。

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目