题目内容
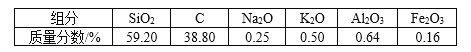
【题目】在容积为2.0 L的密闭容器内,物质D在T ℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是
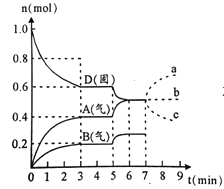
A. 从反应开始到第一次达到平衡时,A物质的平均反应速率为0.0667 mol/(L·min)
B. 该反应的化学方程式为2D(s) 2A(g)+B(g),该反应的平衡常数表达式为K=c(A)2·c(B)
C. 已知:反应的H>0,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
D. 若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是a曲线
【答案】D
【解析】
A.根据v=c/t计算得A物质的平均反应速率为0.4/(2×3)= 0.0667 mol/(L·min),A正确;
B.根据图在第一次达到平衡时A的物质的量增加了0.4mol,B的物质的量增加了0.2mol,所以A、B为生成物,D的物质的量减少了0.4mol/L,所以D为反应物,D、A、B的变化量之比为0.4:0.4:0.2=2:2:1,反应中各物质计量数之比等于物质的浓度的变化量之比,化学方程式为2D(s)![]() 2A(g)+B(g),该反应的平衡常数表达式为K=c(A)2·c(B) ,故B正确;
2A(g)+B(g),该反应的平衡常数表达式为K=c(A)2·c(B) ,故B正确;
C.第5分钟时A、B的物质的量在原来的基础上增加,而D的物质的量在原来的基础上减小,说明平衡正向移动,因为反应的H>0,所以此时是升高温度,故C正确;
D.因为D是固体,量的改变不影响化学平衡,所以A的物质的量不变,故D错误;
综上所述,本题选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】A、B、C、D、E五种短周期元素,A与D同周期,A的单质既可与盐酸反应,又可与NaOH溶液反应,B的单质在放电条件下能与氧气反应,C元素的离子不含电子,D元素原子的最外层电子数是其次外层电子数的3/4,E元素原子的最外层电子数是其次外层电子数的3倍。
(1)A的离子结构示意图为_______________,E元素在周期表的位置是_____________________。
(2)用电子式表示C的氧化物的形成过程____________________________
(3)比较B、D、E的氢化物的沸点由高至低:_____________________________。
(4)化合物甲由元素A、B组成,具有良好电绝缘性。化合物甲能与水缓慢反应生成化合物乙。乙分子中含有10个电子,写出该反应的化学方程式:________________。 。
(5)化学家鲍林在研究含氧酸的强弱时,提出了一个定性规则:含氧酸分子中的非羟基(注:羟基是—OH)氧原子数与酸性强弱成相关性。设含氧酸化学式为HnROm,则非羟基氧原子数为(m-n),其数值越大,该含氧酸的酸性越强。鲍林认为含氧酸的强弱与非羟基氧原子数(m-n)有如下关系:
m-n | 0 | 1 | 2 | 3 |
含氧酸强度 | 弱 酸 | 中 强 | 强 | 很 强 |
实 例 | HClO | H3PO4 | HNO3 | HClO4 |
①规则判断H2CrO4、HMnO4酸性由强到弱的顺序为_________________。
②As为第ⅤA元素,H3AsO3为弱酸,H3PO3为中强酸,试推断H3AsO3的分子结构式为________,H3PO3为的结构式为__________________。
【题目】下表是元素周期表的一部分,针对表中的①~⑧元素回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ④ | ⑤ | ⑥ | |||||
三 | ① | ② | ③ | ⑦ | ⑧ |
(1)在这些元素原子中,失电子能力最强的是____(填元素符号),非金属性最强的元素是___(填元素符号)。
(2)单质化学性质最不活泼的元素是______(填元素符号),其原子结构示意图为_____。
(3)元素的最高价氧化物对应的水化物中,呈两性的是_______(填化学式)。
(4)⑤、⑥所代表的元素分别与氢元素形成的氢化物中,热稳定性较强的是_________(填化学式)。
(5)在②、⑥、⑦三种元素中原子半径按从大到小的是_______(填元素符号)表中元素最高价氧化物对应的水化物中,酸性最强的是_________(填化学式)。
(6)写出元素③的单质与稀盐酸反应的化学方程式____________。