题目内容
【题目】化石燃料开采、加工过程产生的H2S废气可以通过多种方法进行治理.可以制取氢气,同时回收硫单质,既廉价又环保。回答下列问题:
(1)已知:2H2(g)+O2(g)=2H2O(g) △H1
S(s)+ O2(g)=SO2(g) △H2
2S(s)![]() S2(g) △H3
S2(g) △H3
2H2S(g)+SO2(g)=3S(s)+2H2O(g) △H4
则反应2H2S(g)![]() 2H2(g)+ S2(g)的△H=_____
2H2(g)+ S2(g)的△H=_____
(2)工业上采州高温热分解HzS的方法制取H2,在膜反应器中分离出H2。
在恒容密闭容器中,阻H2S的起始浓度均为0.009 mol/L控制不同温度进行H2S分解:![]() ,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度F反应经过相同时间时H2S的转化率。
,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度F反应经过相同时间时H2S的转化率。
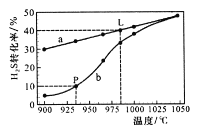
①在935℃时,该反应经过t s H2S的转化率达到P点数值,则在ts内用H2浓度变化表示的平均反应速率v(H2)=________。
②温度升高,平衡向____方向移动(填“正反应”“逆反应”),平衡常数____(填“增大”“减小”或“不变”)。985℃时该反应的平衡常数为________。
③随着H2S分解温度的升高,曲线b逐渐向曲线a靠近,其原因是___________。
(3)电解法治理硫化氢是先用FeCl3溶液吸收含H2S的工业废气,所得溶液用惰性电极电解,阳极区所得溶液循环利用。
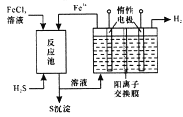
①进入电解池的溶液中,溶质是____。
②阳极的电极反应式为________________。
③电解总反应的离子方程式是____________。
【答案】 ΔH2+ΔH3+ΔH4-ΔH1 ![]() mol/(L·s) 正反应 增大 8×10-4 该分解反应是吸热反应,温度升高,分解速率加快,达到平衡所需时间缩短 FeCl2、HCl Fe2+-e-== Fe3+ 2Fe2++2H+
mol/(L·s) 正反应 增大 8×10-4 该分解反应是吸热反应,温度升高,分解速率加快,达到平衡所需时间缩短 FeCl2、HCl Fe2+-e-== Fe3+ 2Fe2++2H+![]() 2Fe3++H2↑
2Fe3++H2↑
【解析】(1)根据盖斯定律:②+③+④-①可得![]() ΔH2+ΔH3+ΔH4-ΔH1答案为:ΔH2+ΔH3+ΔH4-ΔH1
ΔH2+ΔH3+ΔH4-ΔH1答案为:ΔH2+ΔH3+ΔH4-ΔH1
(2)①由图像可知在935℃时,该反应经过ts 时H2S的转化率为10%,则v(H2)=![]() =
=![]() mol/(L·s) ②由图像可知温度越高H2S的转化率越大,说明H2S的分解是吸热反应,根据勒夏特列原理,温度升高平衡向正反应方向移动,同时平衡常数增大大;985℃时H2S的起始浓度为0.009 mol/L, H2S的转化率为40%,则
mol/(L·s) ②由图像可知温度越高H2S的转化率越大,说明H2S的分解是吸热反应,根据勒夏特列原理,温度升高平衡向正反应方向移动,同时平衡常数增大大;985℃时H2S的起始浓度为0.009 mol/L, H2S的转化率为40%,则 ![]()
开始![]() )0.009 00
)0.009 00
转化![]() )0.00360.0360.0018
)0.00360.0360.0018
平衡![]() ) 0.00540.0036 0.0018
) 0.00540.0036 0.0018
所以K=![]() =8×10-4 mol/L
=8×10-4 mol/L
③该反应是吸热反应,温度升高,化学反应速率加快,会使达到平衡所用的时间缩短,导致曲线b逐渐向曲线a靠近。答案为:① 正反应 、增大 ②8×10-4 mol/L ③ 该分解反应是吸热反应,温度升高,分解速率加快,达到平衡所需时间缩短
(4)①反应池中FeCl3与H2S反应生成硫单质、FeCl2、HCl,FeCl2和HCl进入电解池的溶液中,所以溶质为FeCl2、HCl。②电解池的阳极发生氧化反应,二价铁离子失去1个电子生成三价铁离子,电极反应式为Fe2+-e-== Fe3+。③电解氯化亚铁时,阴极发生氢离子得电子的还原反应,2H++2e-═H2↑,阳极亚铁离子发生失电子的氧化反应,2Fe2+═2Fe3++2e-,根据两极反应可写总的电解反应为:2Fe2++2H+![]() 2Fe3++H2↑。答案为:①FeCl2、HCl ②Fe2+-e-== Fe3+③2Fe2++2H+
2Fe3++H2↑。答案为:①FeCl2、HCl ②Fe2+-e-== Fe3+③2Fe2++2H+![]() 2Fe3++H2↑
2Fe3++H2↑

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Cu2+、Ba2+、C1—、SO42—、CO32-。将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
实验序号 | 实验内容 | 实验结果 |
a | 加AgNO3溶液 | 有白色沉淀生成 |
b | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
c | 加足量BaC12溶液,将所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
试回答下列问题:
(1)该混合物中一定不存在的离子是______________________。
(2)试写出实验b发生反应的离子方程式_______________________。
(3)溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 | 物质的量浓度(mol·L—1) |
___________ | ___________ |
___________ | ___________ |
(4)判断混合物中是否存在K+,如果不存在,请说明理由,如果存在,请求出C(K+)的取值范围?______________。
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) ![]() CH3OH(g),△H1
CH3OH(g),△H1
反应Ⅱ:CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g),△H2
CH3OH(g)+ H2O(g),△H2
下表所列数据是反应I在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2 molCO和6molH2充入2L的密闭容器中发生反应I,5min后测得c(CO)=0.4 mol/L,计算此段时间的反应速率(用H2表示)___________ mol/(L·min)。
(2)由表中数据判断△H1_____0(填“>”、“<”或“=”)反应,C02(g)+H2(g)![]() CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
(3)若容器容积不变,下列措施可提高反应Ⅰ中CO转化率的是_________(选字母)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
e.充入He,使体系总压强增大
d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:K=_________;保持恒温恒容的条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,则化学平衡_________(填“正向”、“逆向”或“不”)移动,平衡常数K____(填“变大”、“变小”或“不变”)。