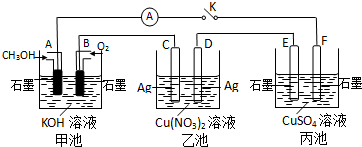
题目内容
8.实验室用锌粒与2mol•L-1硫酸溶液制取氢气,下列措施能增大化学反应速率的是( )| A. | 加入CH3COONa溶液 | B. | 改用3 mol•L-1盐酸 | ||
| C. | 用锌粉代替锌粒 | D. | 加入少量铜粉 |
分析 增大锌粒与稀硫酸的反应速率,可从影响反应速率的外界因素思考,可增大浓度、升高温度、增大固体的表面积以及形成原电池反应等,以此解答该题.
解答 解:A.加入CH3COONa溶液与硫酸反应生成醋酸,氢离子浓度降低,所以反应速率减小,故D错误;
B.改用3 mol•L-1盐酸,氢离子浓度由4mol•L-1变成3 mol•L-1,氢离子浓度降低,所以反应速率减小,故B错误;
C.用锌粉代替锌粒,固体表面积增大,接触面积增大,则反应速率增大,故C正确;
D.向加入少量铜粉,与锌形成原电池,加快反应速率,故D正确.
故选CD.
点评 本题考查化学反应速率的影响因素,为高频考点,把握温度、浓度、接触面积、原电池对反应速率的影响为解答的关键,注意浓硫酸的性质,题目难度不大.

练习册系列答案
相关题目
18.下列实验方案能够达到预期目的是( )
| A. | 乙醇的消去反应可用水浴加热 | |
| B. | 检验无水乙醇中是否含有少量水:加硫酸铜晶体观察现象 | |
| C. | 区别苯和乙苯:加酸性高锰酸钾溶液,振荡,观察现象 | |
| D. | 检验氯代烃中的氯元素时,可先加入硝酸溶液,再加入硝酸银溶液来进行检验 |
16.鉴别NO2和Br2蒸气,下列实验不可行的是( )
| A. | 溶于水 | B. | 用湿润的淀粉KI试纸 | ||
| C. | 通入AgNO3溶液 | D. | 通入到CCl4中 |
3.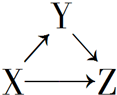 X、Y、Z有如图所示的转化关系,则X和Y可能是( )
X、Y、Z有如图所示的转化关系,则X和Y可能是( )
①Si和SiO2 ②AlCl3和Al(OH)3③CuO和CuSO4 ④Fe和FeCl2.
 X、Y、Z有如图所示的转化关系,则X和Y可能是( )
X、Y、Z有如图所示的转化关系,则X和Y可能是( )①Si和SiO2 ②AlCl3和Al(OH)3③CuO和CuSO4 ④Fe和FeCl2.
| A. | ①②③④ | B. | ①② | C. | ③④ | D. | ①②③ |
13.下列关于氯气的说法不正确的是( )
| A. | 新制氯水可使紫色石蕊试液先变红后褪色 | |
| B. | 将鲜花放入盛有氯气的集气瓶中,鲜花褪色,说明Cl2具有漂白性 | |
| C. | 可以用浓硫酸除去氯气中的水蒸气 | |
| D. | 氢气在氯气中燃烧产生苍白色火焰瓶口有白雾 |
20.欲制取较纯净的1,2二氯乙烷,可采取的方法是( )
| A. | 乙烯与HCl加成 | |
| B. | 乙烯与Cl2加成 | |
| C. | 乙烷与Cl2按1:2的体积比在光照条件下反应 | |
| D. | 乙烯先与HCl加成,再与等物质的量的Cl2在光照下反应 |
17.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 0.1 mol 的2H35Cl分子中的中子数是2NA | |
| B. | 1 mol乙醇所含的羟基的电子数是9NA | |
| C. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| D. | 将2.24 L(标准状况下)CO2通入1 L 0.15 mol•L-1的NaOH溶液中,所得CO32-和HCO3-物质的量均为0.05mol |
4.乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
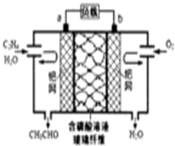

| A. | 每有0.1molO2反应,则迁移H+0.4mol | |
| B. | 该电池为可充电电池 | |
| C. | 电子移动方向:电极a→磷酸溶液→电极b | |
| D. | 正极反应式为:CH2=CH2-2e-+2OH→CH3CHO+H2O |