题目内容
16.鉴别NO2和Br2蒸气,下列实验不可行的是( )| A. | 溶于水 | B. | 用湿润的淀粉KI试纸 | ||
| C. | 通入AgNO3溶液 | D. | 通入到CCl4中 |
分析 二氧化氮和水反应生成硝酸和NO,而溴可溶于水,溴水呈橙黄色,可与硝酸银溶液反应生成浅黄色沉淀;二者都具有强氧化性,但溴易溶于有机溶剂,以此来解答.
解答 解:A.NO2溶于水为无色溶液,而Br2蒸气溶于水为橙黄色,现象不相同,能鉴别,故A正确;
B.NO2和Br2蒸气均能氧化KI中的碘离子生成碘单质,遇淀粉变蓝,现象相同,不能鉴别,故B错误;
C.二氧化氮通入到硝酸银溶液,有气体生成,而溴蒸气通入到硝酸银溶液中生成AgBr浅黄色沉淀,现象不同,能鉴别,故C正确;
D.溴易溶于四氯化碳,分层后有机层为橙色,而二氧化氮不能,现象不相同,能鉴别,故D正确;
故选B.
点评 本题考查物质的鉴别,为高频考点,把握物质的化学性质和物理性质及性质差异为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
6.下列物质的电子式书写正确的是( )
| A. | NaCl  | B. | H2S  | C. | Na2O  | D. | NH4I  |
7.在铜制品上的铝质铆钉,在潮湿空气中容易腐蚀的原因是( )
| A. | 形成原电池时,铝作阴极极 | |
| B. | 形成原电池时,铜作负极 | |
| C. | 形成原电池时,电流由铝经导线流向铜 | |
| D. | 铝铆钉发生了电化学腐蚀 |
1.下列关于周期表中有关族的叙述,正确的是( )
| A. | I A族元素又称为碱金属元素 | |
| B. | 副族和Ⅷ族中的元素均为过渡元素 | |
| C. | 族的序数都等于该族元素原子的最外层电子数 | |
| D. | 元素周期表中每个纵列为一族,共有18个族 |
8.实验室用锌粒与2mol•L-1硫酸溶液制取氢气,下列措施能增大化学反应速率的是( )
| A. | 加入CH3COONa溶液 | B. | 改用3 mol•L-1盐酸 | ||
| C. | 用锌粉代替锌粒 | D. | 加入少量铜粉 |
12.某种快速充电电池的电极材料分别为锂和石墨,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4LiCl+S+SO2$?_{放电}^{充电}$4Li+2SOCl2.下列说法正确的是( )
| A. | 该电池放电时,负极材料为锂,发生还原反应 | |
| B. | 组装该电池可以在有氧的条件下进行 | |
| C. | 电池放电时电子从负极经外电路流向正极,再从正极经电解液流向负极 | |
| D. | 电池充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2 |

 B.
B. C.
C.

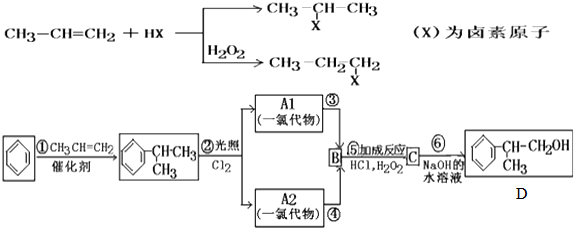
 C的结构简式:
C的结构简式: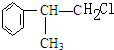 .
. +NaCl.
+NaCl.