题目内容
16.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题: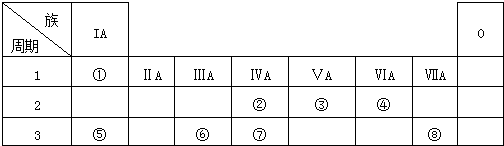
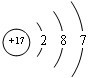
(1)⑧的原子结构示意图为
 .
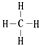
.(2)②的气态氢化物分子的结构式为
 ,②和⑦的气态氢化物的稳定性相比,其中较弱的是SiH4 (用该氢化物的化学式表示).
,②和⑦的气态氢化物的稳定性相比,其中较弱的是SiH4 (用该氢化物的化学式表示).(3)②、③的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3.(填化学式)
(4)⑤、⑥元素的金属性强弱依次为减小.(填“增大”、“减小”或“不变”)
(5)④、⑤、⑥的形成的简单离子半径依次减小.(填“增大”、“减小”或“不变”)
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式:
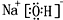 ,形成的晶体是离子晶体.
,形成的晶体是离子晶体.
分析 由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl.
(1)⑧是Cl,原子核外电子数为17,有3个电子层,各层电子数为2、8、7;
(2)②的气态氢化物为CH4,分子中碳原子与氢原子之间形成1对共用电子对;元素非金属性越强,对应氢化物越稳定;
(3)非金属性越强,最高价含氧酸的酸性越强;
(4)同周期自左而右元素金属性减弱;
(5)电子层结构相同的离子,核电荷数越大离子半径越小;
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物为NaOH,由钠离子与氢氧根离子构成.
解答 解:由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl.
(1)⑧是Cl,原子核外电子数为17,有3个电子层,各层电子数为2、8、7,原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)②的气态氢化物为CH4,分子中碳原子与氢原子之间形成1对共用电子对,结构式为: ;同主族自上而下非金属性减弱,元素非金属性越强,对应氢化物越稳定,故氢化物稳定性CH4>SiH4,故答案为:
;同主族自上而下非金属性减弱,元素非金属性越强,对应氢化物越稳定,故氢化物稳定性CH4>SiH4,故答案为: ;SiH4;
;SiH4;
(3)同主族自左而右非金属性增强,非金属性越强,最高价含氧酸的酸性越强,故酸性:HNO3>H2CO3,故答案为:HNO3>H2CO3;
(4)同周期自左而右元素金属性依次减小,故答案为:减小;
(5)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+>Al3+,故答案为:减小;
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物为NaOH,由钠离子与氢氧根离子构成,电子式为,属于离子晶体,故答案为: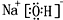 ;离子.
;离子.
点评 本题考查元素周期律和元素周期表,侧重对元素周期律的考查,注意对元素周期表结构掌握、元素周期律的应用,题目难度不大.

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案| A. | 氯化铵与氢氧化钠两种稀溶液混合:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| C. | 氢氧化镁与稀硫酸反应:H++OH-=H2O | |
| D. | 单质铜与稀硝酸反应:Cu+2H++2NO3-=Cu2++2NO↑+H2O |
| A. | 甲烷与氯气反应 | B. | 乙烷的燃烧 | ||
| C. | 乙烯使酸性高锰酸钾溶液褪色 | D. | 乙烯使溴水褪色 |
| A. | 纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 | |
| B. | 鱼虾会产生不愉快的腥臭味,可在烹调时加入少量食醋和料酒 | |
| C. | 被蜂蚁蜇咬会感觉疼痛难忍,这是由于人的皮肤被注入了甲酸的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| D. | 苯酚溶液可用于环境消毒,医用酒精可用于皮肤消毒,其原因均在于可使蛋白质变性凝固 |
| A. |  向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合液加入0.1 mol/L稀H2SO4溶液 向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合液加入0.1 mol/L稀H2SO4溶液 | |
| B. |  向含有0.1 mol/L AlCl3和0.3mol/L NH4Cl的混合液1L中加入0.1mol/L NaOH溶液 向含有0.1 mol/L AlCl3和0.3mol/L NH4Cl的混合液1L中加入0.1mol/L NaOH溶液 | |
| C. |  向氢氧化钠溶液滴加明矾[KAl(SO4)2]溶液,[已知AlO2-和Al3+在溶液中生成Al(OH)3] 向氢氧化钠溶液滴加明矾[KAl(SO4)2]溶液,[已知AlO2-和Al3+在溶液中生成Al(OH)3] | |
| D. |  向AlCl3溶液滴加过量氨水 向AlCl3溶液滴加过量氨水 |
 和
和 ;⑦
;⑦ 和
和
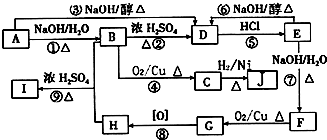
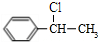 C中含氧官能团的名称为羰基.
C中含氧官能团的名称为羰基.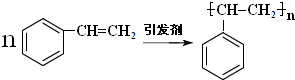 .G与新制Cu(OH)2悬浊液反应的化学方程式
.G与新制Cu(OH)2悬浊液反应的化学方程式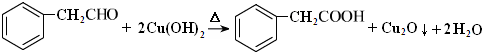 .
.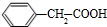 +
+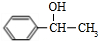 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$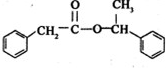 +H2O
+H2O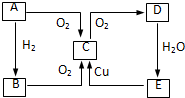 在图中A、B、C、D、E中均含有硫元素,通常状况下,A为固体单质,根据右图的转化关系,回答:
在图中A、B、C、D、E中均含有硫元素,通常状况下,A为固体单质,根据右图的转化关系,回答: ,共价键
,共价键