题目内容
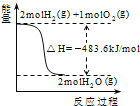
【题目】已知热化学方程式:C2H2(g)+![]() O2(g)=2CO2(g)+H2O(g)
O2(g)=2CO2(g)+H2O(g)![]() H=-1256 kJ·mol-1。下列说法正确的是( )
H=-1256 kJ·mol-1。下列说法正确的是( )
A.C2H2的燃烧热为1256kJ/mol
B.若生成2mol液态水,则![]() H=-2512kJ/mol
H=-2512kJ/mol
C.若转移10mol电子,则消耗2.5mol O2
D.若形成4mol碳氧共用电子对,则放出的热量为2512kJ
【答案】C
【解析】
A. 燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,水的稳定状态是液态。故A错误;
B. 气态水生成液态是放出热量,故B错误;
C. 1mol氧气得到4mol电子,所以转移10mol电子,需要2.5mol氧气,故C正确;
D. 形成4mol碳氧共用电子对,则生成2molCO2,放出的热量为1256kJ,故D错误;
答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:
C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1
根据盖斯定律,写出298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)热化学方程式:__________________________________________。
(2)在1.0 L真空密闭容器中充入4.0 mol A(g)和4.0 mol B(g),在一定温度下进行反应:A(g)+B(g)C(g) ΔH,测得不同时刻该容器内物质的物质的量如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(A)/mol | 4.0 | 2.5 | 1.5 | n2 | n3 |
n(C)/mol | 0 | 1.5 | n1 | 3 | 3 |
回答下列问题:
①随着温度的升高,该反应的化学平衡常数减小,则ΔH___(填“>”“<”或“=”)0,反应从起始到30min内A的平均反应速率是_______,该温度下,上述反应的化学平衡常数为____。
②下列选项中能说明该反应在一定温度和恒容条件下达到平衡状态的是________。
A. 反应速率:vA(正) =vC(逆) B. A的质量和C的质量相等
C. B的转化率不再改变 D. 密度不再改变
(3)若反应C(g)A(g)+B(g)进行时需加入稀释剂X气体(不参与反应),则C的平衡转化率与压强、X的物质的量的关系如图所示。
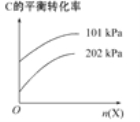
当其他条件不变时,增大X的物质的量,C的平衡转化率将________(填“增大”“减小”或“不变”),其原因是______________________________。
【题目】
Ⅰ.室温下,现有c(H+) 相同的醋酸甲和盐酸乙:
(1)相同条件下,取等体积的甲乙两溶液,各稀释100倍。稀释后的溶液,其c(H+) 大小关系为:
甲 _____________乙 (填“大于”“小于”或“等于”,下同)。
(2)各取25 mL的甲乙两溶液,分别与等浓度的NaOH稀溶液完全反应,则消耗的NaOH溶液的体积大小关系为V(甲) _____________ V(乙)。
Ⅱ.已知25 ℃时有关弱酸的电离平衡常数如下:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
(1)25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
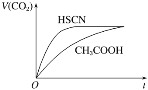
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 _____________。
(2)若保持温度不变,在醋酸溶液中通入一定量氨气,下列各量会变小的是 ______________(填字母)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
III.(1)HClO4H2SO4HCl和HNO3都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数,下列说法不正确的是 _________。
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | Ka1:6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
A.温度会影响这四种酸在冰醋中的电离常数
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4===2H++SO42-
D.这四种酸在冰醋酸中都没有完全电离,但仍属于强电解质
(2)亚磷酸是二元中强酸,25 ℃时亚磷酸(H3PO3)的电离常数为K1=1×10-2K2=2.6×10-7。
①试从电离平衡移动的角度解释K1为什么比K2大_______________________ 。
②写出亚磷酸的电离方程式(2步)_________________;_______________ 。
③请设计一种方案,使之能通过直观的实验现象判断醋酸的酸性强于H2S,该方案所用的试剂是 __________,反应的化学方程式为 _____________________。
【题目】某小组研究AgCl的溶解平衡:向10 mL 1mol/L KCl 溶液中加入1 mL 0.2 mol/LAgNO3溶液,将浑浊液均分为2份,进行如下实验:
实验序号 | 实验操作 | 实验现象 |
I | 将其中一份浑浊液过滤,向滤液中放入Mg条
| i. 滤液澄清透明,用激光照射有丁达尔现象。 ii. 放入Mg条后,立即有无色气泡产生,气体可燃,滤液中出现白色浑浊。 iii. 一段时间后开始出现棕褐色浑浊物,Mg条表面也逐渐变为棕褐色,产生气泡的速率变缓慢。 |
II | 向另一份浑浊液中放入大小相同的Mg条
| iv. 棕褐色浑浊物的量明显多于实验I,Mg条表面棕褐色更深,其他现象与ii、iii相同。 |
已知:AgOH不稳定,立即分解为Ag2O(棕褐色或棕黑色),Ag粉为黑色,AgCl、Ag2O可溶于浓氨水生成Ag(NH3)2+
(1)滤液所属分散系为________。
(2)现象ii中无色气泡产生的原因是_________(写出化学方程式)。
(3)现象iii中,导致产生气泡的速率下降的主要影响因素是________。
(4)甲认为Mg条表面的棕褐色物质中一定有Ag和Ag2O,其中生成Ag的离子方程式为____。
(5)甲设计实验检验Ag:取实验I中表面变为棕褐色的Mg条于试管中,向其中加入足量试剂a,反应结束后,继续向其中加入浓硝酸,产生棕色气体,溶液中有白色不溶物。
① 白色不溶物为_____(填化学式),棕色气体产生的原因是_____(写离子方程式)。
② 试剂a为________,加入试剂a的目的是________。
③ 该实验能证明棕褐色物质中一定有Ag的实验现象是________。
(6)甲进一步设计实验验证了Mg条表面的棕褐色物质中有Ag2O,实验方案是:取实验I中表面变为棕褐色的Mg条_________。
(7)综合上述实验,能说明存在AgCl(s) ![]() Ag+(aq) + Cl-(aq)的证据及理由有________。
Ag+(aq) + Cl-(aq)的证据及理由有________。