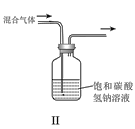
题目内容
【题目】按要求回答下列问题
(1)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。将SO2通入2.0 mol·L-1氨水中(溶液的体积保持不变),当c(OH)降至1.0×107 mol·L1时,溶液中的![]() =______;(NH4)2SO3溶液中的质子守恒_______。
=______;(NH4)2SO3溶液中的质子守恒_______。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因为________________(用离子反应方程式)。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为________。
(3)SOCl2是一种液态化合物,沸点为77℃化合物,在盛有10mL水的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾形成,并有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色,轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色沉淀析出。
①根据上述实验,写出 SOCl2和水反应的化学方程式________________。
②SOCl2与AlCl3·6H2O 混合共热,可得到无水AlCl3,其原因是__________。
(4)当意外失火时,将泡沫灭火器倒过来即可使药液混合,喷出泡沫状物品,阻止火势蔓延,其相关的离子反应方程式为___________________________。
【答案】0.62 c(H+)+c(HSO3-)+2c(H2SO3)=c(NH3·H2O)+c(OH-) CO32-+H2O![]() HCO3-+OH- Na2CO3+CaSO4·2H2O=CaCO3+Na2SO4+2H2O SOCl2+H2O=SO2↑ + 2HCl↑ SOCl2和H2O生成SO2和HCl,生成HCl抑制AlCl3的水解 Al3++3HCO3- = Al(OH)3↓+3CO2↑
HCO3-+OH- Na2CO3+CaSO4·2H2O=CaCO3+Na2SO4+2H2O SOCl2+H2O=SO2↑ + 2HCl↑ SOCl2和H2O生成SO2和HCl,生成HCl抑制AlCl3的水解 Al3++3HCO3- = Al(OH)3↓+3CO2↑
【解析】
(1)H2SO3的Ka2=![]() =6.2×10-8和溶液中c(H+)=1.0×10-7molL-1计算可得;整合电荷守恒关系和物料守恒关系得质子守恒关系;
=6.2×10-8和溶液中c(H+)=1.0×10-7molL-1计算可得;整合电荷守恒关系和物料守恒关系得质子守恒关系;
(2)Na2CO3为强碱弱酸盐,CO32-结合水电离的氢离子,生成HCO3-、H2CO3,破坏水的电离平衡;加入(CaSO4·2H2O)后,CaSO4与Na2CO3反应生成CaCO3,CO32-浓度降低,CO32-水解平衡向左移动,OH-浓度降低;
(3)由题意可知,SOCl2和水反应生成二氧化硫和氯化氢;SOCl2与AlCl3·6H2O混合共热时,SOCl2和结晶水反应生成二氧化硫和氯化氢,既减少了水的量,同时生成的HCl又抑制了AlCl3的水解;
(4)碳酸氢钠水解导致溶液呈碱性,硫酸铝水解导致其溶液呈酸性,碳酸氢钠和硫酸铝在水溶液中能相互促进水解生成二氧化碳和氢氧化铝;
(1)H2SO3的Ka2=![]() =6.2×10-8,将SO2通入2.0 mol·L-1氨水中(溶液的体积保持不变),当c(OH)降至1.0×107 mol·L1时,溶液中c(H+)=1.0×10-7molL-1,则
=6.2×10-8,将SO2通入2.0 mol·L-1氨水中(溶液的体积保持不变),当c(OH)降至1.0×107 mol·L1时,溶液中c(H+)=1.0×10-7molL-1,则![]() =
=![]() =0.62;由题意可知,NH3·H2O的Kb=1.8×105>Ka2=6.2×108,则(NH4)2SO3溶液呈碱性,溶液中存在电荷守恒关系c(H+)+ c(NH4+)=c(HSO3-)+2c(SO32—) +c(OH-),存在物料守恒关系c(NH3·H2O) + c(NH4+)=2c(HSO3-)+2c(SO32—) +2c(H2SO3),整合电荷守恒关系和物料守恒关系得质子守恒关系为c(H+)+c(HSO3-)+2c(H2SO3)=c(NH3·H2O)+c(OH-),故答案为:0.62;c(H+)+c(HSO3-)+2c(H2SO3)=c(NH3·H2O)+c(OH-);
=0.62;由题意可知,NH3·H2O的Kb=1.8×105>Ka2=6.2×108,则(NH4)2SO3溶液呈碱性,溶液中存在电荷守恒关系c(H+)+ c(NH4+)=c(HSO3-)+2c(SO32—) +c(OH-),存在物料守恒关系c(NH3·H2O) + c(NH4+)=2c(HSO3-)+2c(SO32—) +2c(H2SO3),整合电荷守恒关系和物料守恒关系得质子守恒关系为c(H+)+c(HSO3-)+2c(H2SO3)=c(NH3·H2O)+c(OH-),故答案为:0.62;c(H+)+c(HSO3-)+2c(H2SO3)=c(NH3·H2O)+c(OH-);
(2)Na2CO3为强碱弱酸盐,CO32-在溶液中水解生成HCO3-、H2CO3,破坏水的电离平衡,使土壤呈碱性,CO32-在溶液中水解以一级水解为主,则水解的离子方程式CO32-+H2O![]() HCO3-+OH-;加入(CaSO4·2H2O)后,CaSO4与Na2CO3反应生成CaCO3,降低CO32-浓度,使CO32-水解平衡向左移动,OH-浓度降低,反应的化学方程式为CaSO4·2H2O +Na2CO3=CaCO3↓+Na2SO4+2H2O,故答案为:CO32-+H2O
HCO3-+OH-;加入(CaSO4·2H2O)后,CaSO4与Na2CO3反应生成CaCO3,降低CO32-浓度,使CO32-水解平衡向左移动,OH-浓度降低,反应的化学方程式为CaSO4·2H2O +Na2CO3=CaCO3↓+Na2SO4+2H2O,故答案为:CO32-+H2O![]() HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O![]() H2CO3+OH-;CaSO4·2H2O +Na2CO3=CaCO3↓+Na2SO4+2H2O;
H2CO3+OH-;CaSO4·2H2O +Na2CO3=CaCO3↓+Na2SO4+2H2O;
(3)①由题意可知,白雾为盐酸的小液滴,即会产生HCl,同时有带刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色说明是SO2,则SOCl2和水反应生成二氧化硫和氯化氢,反应的化学方程式为SOCl2+H2O=SO2↑+2HCl↑,故答案为:SOCl2+H2O=SO2↑+2HCl↑;
②由于铝离子在溶液中水解,SOCl2与AlCl3·6H2O混合共热时,SOCl2和结晶水反应生成二氧化硫和氯化氢,既减少了水的量,同时生成的HCl又抑制了AlCl3的水解,从而得到无水AlCl3,故答案为:SOCl2和H2O生成SO2和HCl,生成HCl抑制AlCl3的水解;
(4)硫酸铝是强酸弱碱盐能水解使溶液中氢离子浓度大于氢氧根离子浓度而导致其溶液呈酸性,碳酸氢钠的水溶液呈碱性,碳酸氢钠和硫酸铝在水溶液中能相互促进水解生成二氧化碳和氢氧化铝,反应的离子方程式为:3HCO3-+Al3+=Al(OH)3↓+3CO2↑,故答案为:3HCO3-+Al3+=Al(OH)3↓+3CO2↑。

【题目】某小组利用 H2C2O4 溶液和酸性 KMnO4 溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
编号 | H2C2O4 溶液 | 酸性 KMnO4 溶液 | 温度℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后 H2C2O4 转化为CO2逸出,KMnO4溶液转化为MnSO4,每消耗1 mol H2C2O4转移__________mol 电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为 n(H2C2O4)∶n(KMnO4)≥______________。
(2)探究温度对化学反应速率影响的实验编号是____________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得 KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______________mol·L-1·min-1。
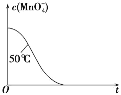
(4)已知50℃时c(MnO4-)~反应时间 t 的变化曲线如图。若保持其他条件不变,请在坐标图中,画出 25℃时c(MnO4-)~t的变化曲线示意图________。
(5)高锰酸钾和草酸反应开始速率较慢,反应一会儿,速率突然加快,合理的原因是_________
【题目】在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g) ΔH<0,已知容器Ⅰ中反应在5 min时到达平衡。
COCl2(g) ΔH<0,已知容器Ⅰ中反应在5 min时到达平衡。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | a | 0.55 | 0 | 0.5 |
Ⅲ | T | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A.容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B.反应Ⅲ的温度T<500℃
C.容器Ⅱ中起始时CO的物质的量为1.0 mol
D.若起始时向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO转化率小于80%]
【题目】下列实验操作、现象与结论均正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 25℃,两片相同的Al片分别和等体积的稀HNO3和浓HNO3反应 | 前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈 | 其他条件相同时,反应物浓度越大,反应速率越快 |
B | 往黄色固体难溶物PbI2中加水,振荡,静置。取上层清液,然后加入NaI固体 | 产生黄色沉淀 | 难溶物PbI2存在沉淀溶解平衡 |
C | 向蛋白质溶液中分别加入乙醇溶液和(NH4)2SO4饱和溶液 | 均产生白色沉淀 | 蛋白质均发生了变性 |
D | 向稀硫酸中加入铜片,然后通入氧气加热 | 开始无明显现象,通入氧气加热后溶液变蓝 | 氧化性:稀硫酸> Cu2+ |
A. A B. B C. C D. D
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持装置已略)。
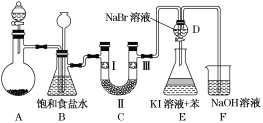
(1)制备氯气选用的试剂为漂粉精固体和浓盐酸,则相关反应的化学方程式为________________。
(2)装置B中饱和食盐水的作用是__________________________________;
同时装置B也是安全瓶,监测实验进行时装置C是否发生堵塞,请写出发生堵塞时装置B中的现象: __________________________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此装置C中Ⅰ、Ⅱ、Ⅲ处依次放入________(填字母)。
a | b | c | d | |
Ⅰ | 干燥的 有色布条 | 干燥的 有色布条 | 湿润的 有色布条 | 湿润的 有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的 有色布条 | 湿润的 有色布条 | 干燥的 有色布条 | 干燥的 有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D装置中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为______色,说明氯的非金属性强于溴。
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡后静置。观察到的现象是________。
【题目】自20世纪60年代以后,人们发现了120多种含铁硫簇![]() 如
如![]() 、
、![]() 、
、![]() 等
等![]() 的酶和蛋白质。它是存在于生物体的最古老的生命物质之一。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验:
的酶和蛋白质。它是存在于生物体的最古老的生命物质之一。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验:
实验一:测定硫的质量:
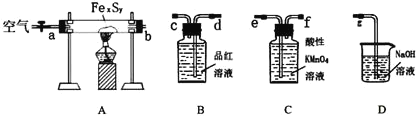
(1)连接装置,请填写接口顺序:b接____________________
(2)检查装置的气密性,在A中放入0.4g铁硫簇的样品![]() 含有不溶于水和盐酸的杂质
含有不溶于水和盐酸的杂质![]() ,在B中加入品红溶液,在C中加入30mL 0.1mol/L的酸性
,在B中加入品红溶液,在C中加入30mL 0.1mol/L的酸性![]() 溶液.
溶液.
(3)通入空气并加热,发现固体逐渐转变为红棕色.
(4)待固体完全转化后,取C中的![]() 溶液
溶液![]() ,用0.1mol/L的碘化钾
,用0.1mol/L的碘化钾![]() 溶液进行滴定。记录数据如下:
溶液进行滴定。记录数据如下:
滴定次数 | 待测溶液体积 | 消耗碘化钾溶液体积 | |
滴定前刻度 | 滴定后刻度 | ||
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
实验二:测定铁的质量:
取实验Ⅰ中A的硬质玻璃管中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经灼烧得0.32g固体.试回答下列问题:
(1)检查“实验一”中装置A的气密性的方法是_________
(2)滴定终点的判断方法是_________
(3)装置B中品红溶液的作用是_______![]() 有同学提出,撤去B装置,对实验没有影响,你的看法是______
有同学提出,撤去B装置,对实验没有影响,你的看法是______![]() 选填“合理”或“不合理”
选填“合理”或“不合理”![]() ,理由是_________
,理由是_________
(4)用KI溶液滴定![]() 溶液时发生反应的离子方程式为_________
溶液时发生反应的离子方程式为_________
(5)请计算这种铁硫簇结构的化学式_________
(6)下列操作,可能引起![]() 偏大的是_________
偏大的是_________
![]() 滴定剩余
滴定剩余![]() 溶液时,KI溶液滴到锥形瓶外边一滴
溶液时,KI溶液滴到锥形瓶外边一滴
![]() 配制KI溶液时,定容时俯视刻度线
配制KI溶液时,定容时俯视刻度线
![]() 用碘化钾溶液滴定剩余
用碘化钾溶液滴定剩余![]() 溶液时,滴定前有气泡,滴定后无气泡
溶液时,滴定前有气泡,滴定后无气泡
![]() 实验二中,对滤渣灼烧不充分
实验二中,对滤渣灼烧不充分